Partie A : Du nectar au miel
Les abeilles utilisent le nectar présent dans les fleurs pour
fabriquer leur miel. Le nectar est aspiré par la trompe de la
butineuse, puis il est emmagasiné dans son jabot où il est transformé
en raison de l’absorption d’eau et de l’apport de salive riche en
invertase. De retour à la ruche, la butineuse régurgite le contenu de
son jabot aux ouvrières qui poursuivent la transformation dans leurs
propres jabots.
Lors de cette transformation, le saccharose présent dans le nectar
réagit avec l’eau pour former du glucose et du fructose qui sont les
principaux constituants du miel. La molécule d’eau « casse » la
molécule de saccharose en deux. On parle d’hydrolyse du saccharose.
Cette transformation chimique est une transformation totale.
L’équation de la réaction d’hydrolyse est la suivante :
C
12H
22O
11 + H
2O → C
6H
12O
6 +
C6H12O6.
saccharose (S)+ eau -->glucose (G) + fructose (F)
La température à l’intérieur de la ruche reste égale à 35 °C.
On se propose de déterminer l’ordre de la réaction d’hydrolyse du saccharose.
À température constante, à 𝑝𝐻 = 5 constant, on mélange du saccharose
avec de l’eau (sans invertase) et on suit l’évolution de la
concentration du saccharose en fonction du temps. On obtient le
graphique suivant. [S] désigne la concentration en saccharose à
l’instant 𝑡 :
A.1. Justifier en quoi la transformation chimique peut être considérée comme lente.
A.2. En utilisant la figure, déterminer la concentration initiale en saccharose [S].
A.3. Estimer, en expliquant la démarche, la valeur du temps de demi-réaction t
½.
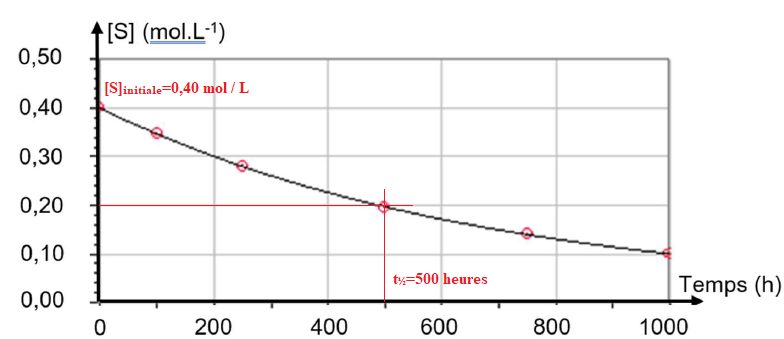
t
½ = 500 heures, la réaction est donc lente.
.A.4. Définir la vitesse volumique de disparition v
dis du saccharose en fonction de la concentration en saccharose [S].
v
dis = -d[S] /dt.
A.5. Indiquer, en justifiant qualitativement, comment varie la vitesse de disparition du saccharose au cours du temps.
v
dis est égale à la valeur absolue du coefficient directeur
de la tangente à la courbe à la date t. Or ces tangentes sont de moins
en moins inclinées sur l'horizontale. L
a vitesse de disparition du saccharose diminue au cours du temps.
On fait l’hypothèse que l’hydrolyse du saccharose suit une loi de
vitesse d’ordre 1. Dans ce cas, on montre que la concentration en
saccharose [S] vérifie la relation ln[S] = −k t + ln[S]
0 avec
t le temps (en h), k la constante de vitesse à la température de l’expérience (en heure) et ln[S]
0 le
logarithme népérien de la concentration initiale en saccharose (sans unité).
Les valeurs de ln[S] ont été calculées puis modélisées par la fonction
ln[S] = −k t + ln[S]0 à l’aide d’un programme Python. On obtient alors le graphique représenté sur la figure 2.
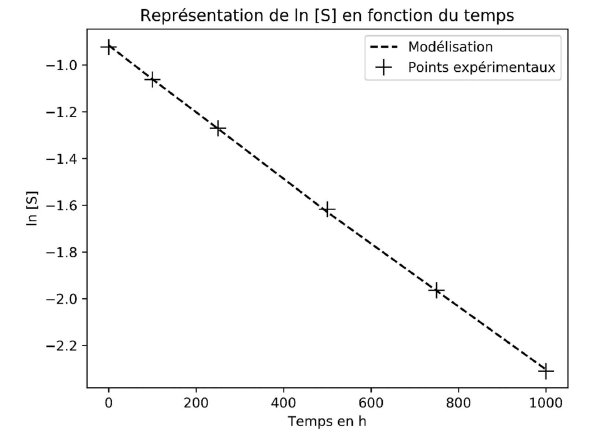 A.6.
A.6. À partir de la modélisation représentée sur la figure 2, justifier que l’hypothèse de la cinétique d’ordre 1 est validée.
Le graphe est une droite de pente négative.
Partie B : Mesure de l’acidité libre d’un miel de châtaignier.
Le miel de châtaignier est majoritairement constitué de sucres (77 %)
et d’eau (19 %) et son 𝑝𝐻 est égal à 4,5. Le principal acide présent
dans le miel est l’acide gluconique dont la formule topologique est :
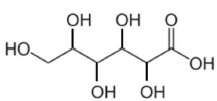
Par souci de simplification, on considèrera que l’acide gluconique est le seul acide présent dans le miel.
La teneur en acidité libre d’un miel s’exprime en milli-équivalents d’acide par kg de miel (mEq/kg).
Elle correspond à la quantité de matière en mmol d’acide gluconique présent dans 1,0 kg de miel.
Pour respecter la règlementation européenne, l’acidité libre d’un miel ne doit pas dépasser 50 mEq/kg.
Protocole pour mesurer l’acidité libre du miel :
- Préparer un bécher avec 50,0 mL de solution aqueuse contenant 5,00 g de miel.
- Remplir la burette graduée avec la solution titrante d'hydroxyde de sodium (Na
+(aq) +HO
-(aq)) de concentration C
b = 1,00 × 10
-2 mol · L
-1.
- Placer la sonde 𝑝𝐻-métrique dans le bécher et mettre en marche l'agitateur magnétique.
- Tracer la courbe représentant le 𝑝𝐻 en fonction du volume de la solution titrante.
On obtient le graphique suivant :
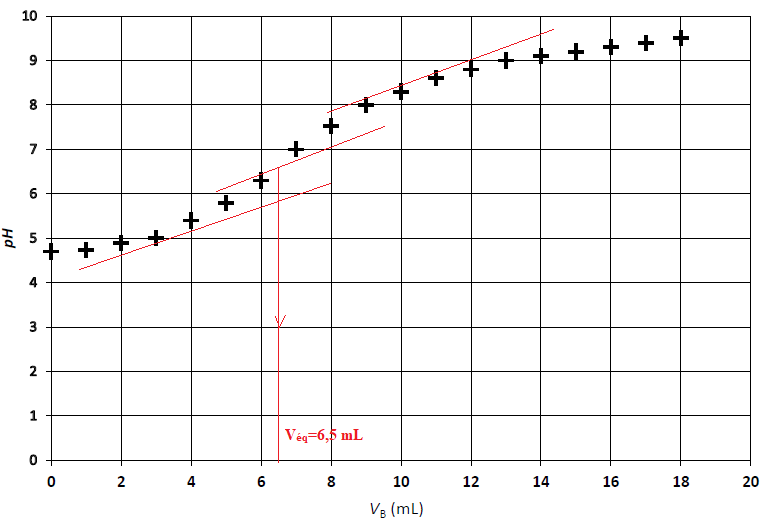 B.1.
B.1. Donner la définition d’un acide selon Brönsted.
Espèce, ion ou molécule, susceptible de céder un proton H
+.
B.2. Si on
considère que l’acide gluconique est le seul acide présent dans le
miel, écrire l’équation de la réaction support du titrage.
C6 H12O7 + HO
-aq --> C
6 H
11O
7 -aq + H
2O(l).
B.3. Définir l’équivalence d’un titrage.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, le réactif titrant
est en défaut ; après l'équivalence il se trouve en excès.
B.4. Déterminer si le miel de châtaignier respecte la règlementation européenne.
A l'équivalence C
aV
a = C
b V
équi =0,010 x 6,5 =0,065 mmol d'acide gluconique dans 5 g de miel.
0,065 x1000 / 5 =13 mmol / kg.
Cette valeur est inférieure à 50, donc le miel est conforme.