Le PLA ou
acide polylactique, bac G
Amérique du Sud 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Le
PLA ou acide polylactique est un polymère dont la demande est
croissante. Il est utilisé dans le secteur des emballages, des fibres,
de la vaisselle jetable ou encore dans les matériaux d’impression pour
les imprimantes 3D.
Il est souvent biosourcé car obtenu à partir de ressources
renouvelables (amidon de maïs) et peut remplacer avantageusement de
nombreux polymères pétrosourcés, car il possède des propriétés
similaires à celles du PS (polystyrène) ou du PET (polyéthylène
téréphtalate). De plus son recyclage chimique est possible. Il peut
donc être une alternative à la pollution des milieux naturels par les
plastiques.
1. La molécule d’acide lactique
On donne la formule topologique de la molécule d’acide lactique :
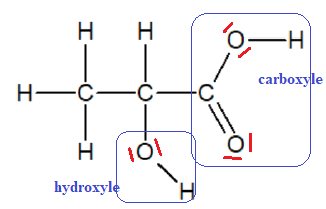 1.1. Dans la nomenclature officielle, l’acide lactique se nomme acide 2-hydroxypropanoïque. Justifier ce nom.
1.1. Dans la nomenclature officielle, l’acide lactique se nomme acide 2-hydroxypropanoïque. Justifier ce nom.
La chaine carbonée compte 3 atomes de carbone comme celle du propane.
Il y a une fonction acide carboxylique d'où acide propanoïque.
Présence d'un groupe hydroxyle sur le carbone n°2, d'où acide 2-hydroxypropanoïque.
1.2. Écrire le couple acide base associé à l’acide lactique en utilisant les schémas de Lewis.
Une solution d’acide lactique de concentration en soluté apporté C= 2,0 × 10–2 mol·L–1 a un pH égal à 2,8.
1.3. Indiquer si, dans ces conditions expérimentales, cet acide est fort ou faible. Justifier.
- log C = -log(0,020) ~1,7.
pH > -log C, donc cet acide est faible.
1.4. Écrire
l’équation de la réaction qui modélise la transformation chimique entre
l’acide lactique et l’eau, en notant AH l’acide lactique.
AH aq + H2O(l) =A-aq + H3O+aq.
2. Synthèse de l’acide polylactique (PLA)
L’une des méthodes suivies pour la polymérisation industrielle de l’acide lactique utilise une réaction de type :
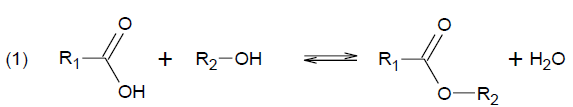
où R1 et R2 sont des groupes alkyles.
2.1. Citer la famille fonctionnelle à laquelle appartient le produit organique formé.
Famille des esters.
Les molécules d’acide lactique réagissent entre elles en chaîne selon
l’équation de la réaction (1) et forment le PLA dont le début de la
chaîne est représenté ci-après :
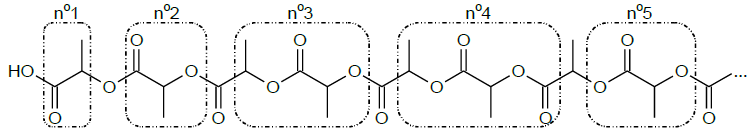
2.2. Parmi les groupements d’atomes encadrés, indiquer celui qui correspond au motif du polymère obtenu.
n° 2.
|
...
|
....
|
3. Dégradation de l’acide polylactique (PLA)
Une dépolymérisation du PLA consiste à faire réagir le polymère avec du
méthanol. Le PLA est ainsi transformé en lactate de méthyle. Celui-ci
peut ensuite être transformé en lactide, pouvant reconduire
ultérieurement au polymère, dans la perspective du recyclage du PLA.
La dépolymérisation du PLA est réalisée à différentes températures : 70 °C, 90 °C et 110 °C. On obtient les courbes suivantes.
3.1. Attribuer à T1, T2 et T3 la valeur de température correspondante. Justifier.
La température est un facteur cinétique. A température plus élevée, la dégradation est plus rapide.
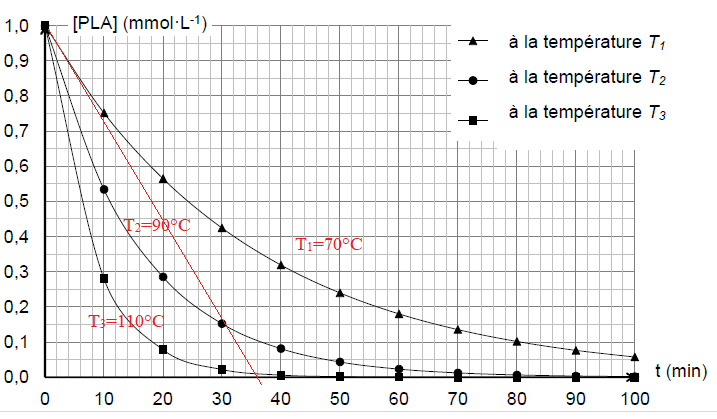
3.2. L’exploitation de la courbe obtenue à la température T1 permet d’obtenir les résultats suivants :
date t (min)
|
0
|
20
|
40
|
60
|
80
|
[PLA] mmol / L
|
1,0
|
0,56
|
0,32
|
0,18
|
0,10
|
Vitesse volumique de disparition Vdisp( mmol / L /s)
|
4,6 10-4 |
2,7 10-4 |
1,5 10-4 |
0,85 10-4 |
0,48 10-4 |
| Vdisp / [PLA] (s-1) |
4,6 10-4 |
4,8 10-4
|
4,7 10-4
|
4,7 10-4 |
4,8 10-4 |
3.2.1. Définir la vitesse volumique de disparition du PLA.
Vdisp = - d[PLA] / dt.
3.2.2. Déterminer graphiquement la valeur de la vitesse volumique de disparition du PLA à la date 𝑡=0 s pour la température 𝑇1 afin de compléter le tableau ci-dessus. Décrire la méthode utilisée.
Pente de la tangente à l'origine : -1 / (36 x60) = -4,6 10-4 mmol / L / s.
Vdisp(t=0) =4,6 10-4 mmol / L / s.
3.2.3. Montrer, en explicitant la démarche, que l’évolution de la concentration en PLA suit une loi de vitesse d’ordre 1.
On calcule Vdisp / [PLA] (s-1) ( voir 4-ème ligne du tableau ).
Vdisp / [PLA] (s-1) ~ 4,7 10-4= constante.
Par suite Vdisp= 4,7 10-4 [PLA] . Loi de vitesse d'ordre 1.
|
|