Le varroa (destructor)
est un acarien qui parasite les
abeilles et entraîne la destruction de très nombreuses
colonies d’abeilles dans le monde.
L’utilisation d’un diffuseur contenant une solution d’acide
méthanoïque permet de l’éradiquer.
Cet exercice porte sur l’étude de quelques propriétés de
l’acide méthanoïque, puis sur la détermination de la
concentration en acide méthanoïque d’une solution
commerciale pour la comparer à l’indication donnée par
le fabricant : solution aqueuse contenant 65,0 g d’acide
méthanoïque pour 100 mL de solution.
Propriétés de l’acide méthanoïque
1. Citer la définition d’un acide selon la théorie de Brönsted
et donner les noms de deux acides usuels.
Un acide est une espèce, ion ou molécule suceptible de céder un proton H
+.
L'acide éthanoïque ou acétique ; l'acide chlorhydrique ; l'acide
sulfurique..
2. Donner la formule de
l’ion méthanoate, base conjuguée de l’acide méthanoïque.
HCOO
-.
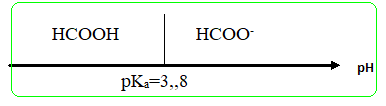
3. Représenter le
diagramme de prédominance de l’acide méthanoïque et de sa base
conjuguée.
Justifier.
A pH inférieur à pKa, la forme acide prédomine ; ç pH supérieur à pKa,
la forme base prédomine.
 4.
4. Parmi les
trois spectres infrarouge A, B et C ci-après, identifier celui pouvant
être attribué à l’acide
méthanoïque. Justifier la réponse.
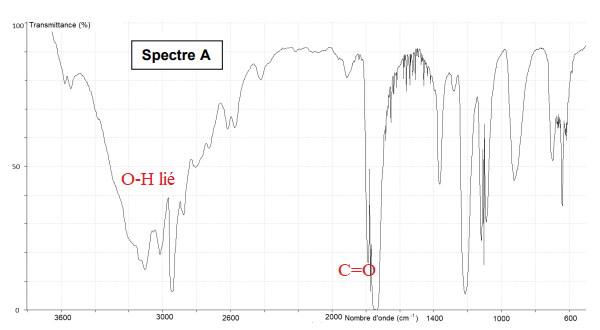
Dans le spectre B, on n'observe pas de large bande vers 3000 cm
-1
: il ne convient pas.
Dans le spectre
C, on n'observe pas bande fine et intense vers 1700 cm-1 :
il ne convient pas.
Titrage de l’acide
méthanoïque contenu dans la solution commerciale de traitement
anti-acarien.
Un titrage de l’acide méthanoïque contenu dans une solution
commerciale de traitement anti-acarien par une
solution aqueuse d’hydroxyde de sodium est réalisé en mettant en œuvre
le protocole suivant.
Protocole du titrage :
- Diluer 1 000 fois la solution commerciale.
- Prélèver un volume V
a = 20,0 mL de la solution diluée S
a
de concentration 𝐶
0.
- Titrer le prélèvement par une solution aqueuse d’hydroxyde de sodium
(Na
+(aq) + HO
−(aq)) de
concentration C
b = 2,00 × 10
−2 mol ⋅ L
−1
. Le suivi du titrage est effectué par pH-métrie.
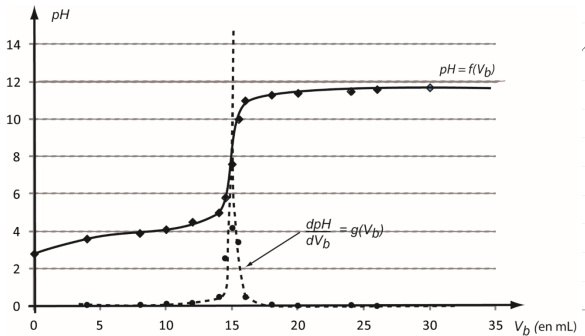
- Utiliser un tableur-grapheur dans lequel sont entrées les différentes
valeurs du pH mesurées en
fonction du volume V
b de solution d’hydroxyde de sodium
ajoutée.
La courbe de titrage p𝐻 = 𝑓(𝑉𝑏), ainsi que la courbe 𝑑p𝐻
𝑑𝑉𝑏
= 𝑔(𝑉𝑏
) obtenues à l’aide des données du tableur grapheur sont présentées.
 .
.