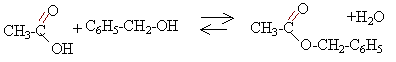Physique
chimie, synthèse de la menthone à partir du menthol
Synthèse d'un ester et convoyage de médicaments
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
.
.
|
......
.....
|
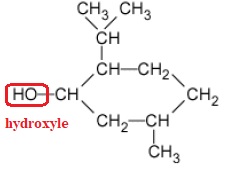
1. La
formule semi-développée du menthol est représentée ci-après.
Justifier le fait que le menthol fasse partie de la famille des alcools.
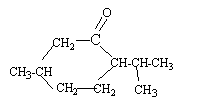
2. Sachant que lors
de l’oxydation ménagée du menthol en menthone seul le groupe
caractéristique est modifié et que la menthone appartient à la famille
des cétones, représenter la formule semi-développée de la molécule de
menthone.
 3. L'oxydation du menthol est
réalisée en milieu acide par
l'ion permanganate MnO4-
qui appartient au couple
oxydo-réducteur MnO4-
/ Mn2+. Cette
oxydation se traduit par l'équation bilan suivant :
2MnO4- + 5C9H18CHOH
+ 6H3O+
--> 2Mn2+ + 5C9H18CO
+ 14H2O.
3. L'oxydation du menthol est
réalisée en milieu acide par
l'ion permanganate MnO4-
qui appartient au couple
oxydo-réducteur MnO4-
/ Mn2+. Cette
oxydation se traduit par l'équation bilan suivant :
2MnO4- + 5C9H18CHOH
+ 6H3O+
--> 2Mn2+ + 5C9H18CO
+ 14H2O.
Justifier le fait que le menthol subit une oxydation.
C9H18CHOH + 2H2O
--> C9H18CO
+ 2H3O++2e- .
Le menthol cède des électrons : c'est un réducteur qui s'oxyde.
4. On réalise, au
laboratoire du lycée, l’oxydation d’une masse m=15,6 g de menthol. par
un volume V =200mL d’une solution aqueuse acide permanganate de
potassium dont la concentration en ions permanganate est C=0,5 mol . L−1.
Le mélange est acidifié par quelques millilitres d'acide sulfurique
concentré. Le dispositif expérimental utilisé est celui du chauffage à
reflux.
4.1.
Parmi les montages A, B et C précédents, indiquer celui qu'il convient
de choisir pour réaliser le chauffage à reflux.
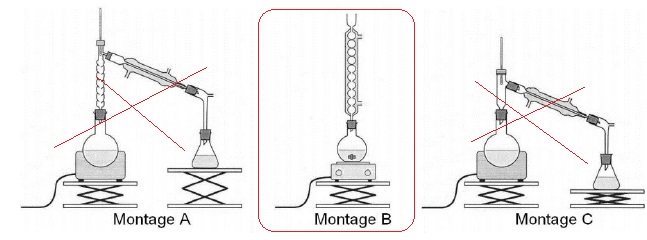
4.2.
Expliquer le rôle des différents éléments de verrerie dans le montage à
reflux.
Le ballon contient le mélange réactionnel chauffé et agité : la
température est un facteur cinétique.
Dans le réfrigérant à eau, les vapeurs se condensent et retombent dans
le milieu réactionnel : il n'y a pas de pertes de matière.
4.3.
En s’aidant éventuellement d’un tableau d’avancement, montrer que, lors
de cette oxydation, le menthol est le réactif limitant.
Quantités de matière initiales :
Menthol : n1 = 15,6 / 156 = 0,10 mol.
Ion permanganate : 0,2 x 0,5 = 0,1 mol.
Etat
|
avancement
(mol)
|
2MnO4- |
5C9H18CHOH |
5C9H18CO |
initial
|
0
|
0,1
|
0,10
|
0
|
en
cours
|
x
|
0,1-2x
|
0,10-5x
|
5x
|
final
|
xfin=0,10
/ 5 = 0,02
|
0,1-2
*0,02 = 0,06
|
0
|
5*0,02=0,10
|
4.4.
Déterminer la masse théorique maximum mth de menthone que
l’on peut obtenir.
mth = 0,10 *M(menthone) = 0,10 *154 = 15,4 ~15 g.
4.5.
On transvase le contenu du ballon dans une ampoule à décanter et on y
ajoute 20 mL d’un solvant extracteur. On agite puis on laisse reposer.
On observe la séparation de 2 phases, la phase organique surnageant.
Déterminer quel solvant, parmi le dichlorométhane, le cyclohexane,
l’éthanol et l’eau, a été utilisé pour extraire la menthone du mélange
réactionnel. Justifier.
Le solvant utilisé est moins dense que l'eau : il occupe la partie
supérieure de l'ampoule.
Ce solvant ne doit pas être miscible avec l'eau.
La menthone doit être très soluble dans ce solvant.
Donc dichlorométhane. 6. La séparation de la menthone du
solvant extracteur se fait en réalisant une distillation.
En fin d’opération on obtient une masse mexp=10,3 g de
distillat que l’on considère être de la menthone pure. On réalise le
spectre infrarouge du distillat ; il est reproduit ci-après.
6.1. Justifier que
le spectre précédent est compatible avec celui de la menthone.
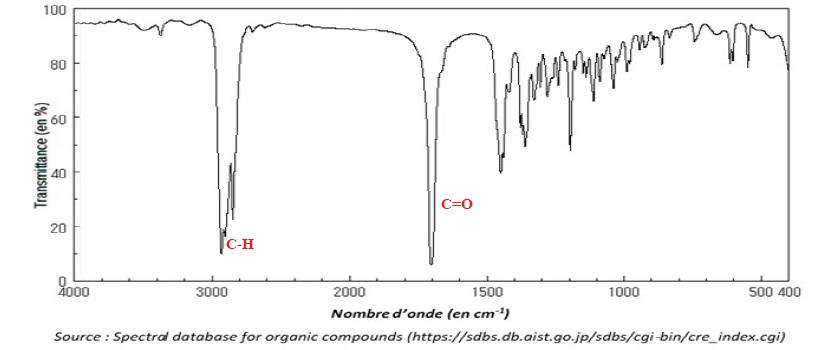
Présence d'un pic intense
vers 1700 cm-1, caractéristique du groupe carbonyle d'une
cétone.
6.2. Déterminer le rendement de
cette synthèse. Conclure.
mexp / mth =10,3 / 15,4 ~0,67.
Ce rendement est assez faible.
|
...
|
|
|
....
|
Synthèse d’un ester et convoyage de médicaments (10 points)
I. Synthèse de l’éthanoate de benzyle au laboratoire.
Le jasmin est un arbuste originaire d’Inde, très cultivé dans les
régions chaudes. L’odeur de fleur de jasmin correspond à la
combinaison de plusieurs espèces chimiques et entre dans la composition
de nombreux parfums. L’une des espèces responsables de la senteur du
jasmin
est l’éthanoate de benzyle. Cet ester est préparé par action de l'acide
éthanoïque sur l'alcool benzylique ; cette transformation est non
totale, lente et un catalyseur, l’acide sulfurique, est ajouté pour la
rendre plus rapide.
Protocole de synthèse mis en oeuvre :
a. Sous la hotte, muni de gants et de lunettes, introduire 15 mL d'acide éthanoïque, 12 mL d'alcool benzylique, quelques gouttes d'acide sulfurique concentré et quelques grains de pierre ponce dans un ballon. Chauffer à reflux ce mélange pendant 30 minutes. Laisser refroidir.
b. Introduire dans l’ampoule à décanter le mélange réactionnel et 50 mL d’une solution saturée dechlorure de sodium. Agiter puis laisser décanter. Récupérer la phase qui contient l’éthanoate de benzyle (phase organique).
c. Sécher la phase organique en y ajoutant quelques cristaux de sulfate de magnésium anhydre.
d. Vérifier la pureté du produit obtenu par spectroscopie infrarouge.
1. Nommer chacune des 4 étapes du protocole notées de a à d.
a. Synthèse de l'ester.
b. Séparation de la phase organique contenant l'ester de la phase aqueuse.
c. Elimination des traces d'eau contenues dans la phase organique.
d. Identification du produit obtenu.
2. Quel est l’intérêt du montage à reflux ?
Le montage à reflux acccélère la réaction ( la température est un
facteur cinétique) tout en évitant les pertes de matière : les vapeurs
se condensent dans le réfrigérant et retombent dans le milieu
réactionnel.
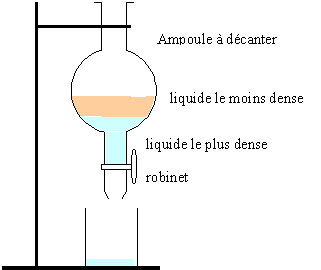
3. Schématiser et légender l’ampoule à décanter après décantation, en précisant la composition de chaque phase. Justifier la position relative des phases.
La phase la moins dense occupe la partie supérieure (ester ).
La phase aqueuse ( acide éthanoïque en excès, acide sulfurique, eau salée saturée), la plus dense occupe la partie inférieure.
4. Écrire l’équation de la réaction modélisant la synthèse de l’éthanoate de benzyle sachant qu’il se forme également de l’eau.
alcool benzylique
+ acide éthanoïque équilibre avec éthanoate de benzyle + eau
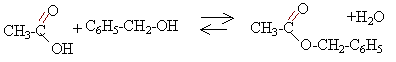
5. On obtient 6,0 g d’éthanoate de benzyle analysé comme pur. Déterminer la valeur du rendement de la synthèse. Commenter cette valeur.
Quantités de matière des réactifs :
acide éthanoïque : volume (mL) x masse volumique ( g / mL) = 15 x1,05 =15,75 g.
Masse / masse molaire de cet acide = 15,75 / 60 =0,2625 mol.
alcool benzilique : volume (mL) x masse volumique ( g / mL) = 12 x1,05 =12,6 g.
Masse / masse molaire de cet alcool = 12,6 / 108 =0,1167 mol ( en défaut).
On peut espérer au mieux obtenir 0,1167 mol d'ester.
masse d'ester théorique :0,1167 x150~ 17,5 g.
Rendement = masse réeel / masse théorique =6,0 / 17,5 ~0,34 ( valeur très faible ).
|
II. Système de convoyage pour les médicaments.
Dans une pharmacie, afin d’optimiser la durée de délivrance des
médicaments, un toboggan est installé entre le premier étage et le
rez-de-chaussée. Un robot combiné à un automate dispose
le médicament sur un tapis roulant, en fonction des commandes. Le
pharmacien réceptionne le produit à l’étage inférieur pour le donner au
client. Le schéma du dispositif est représenté ci-dessous.
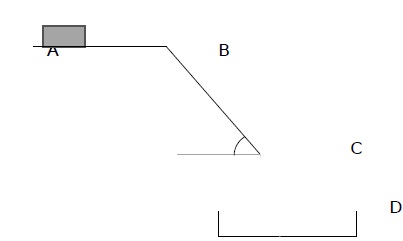
On considère une boîte de médicament de masse 300 g placée sur un
tapis. Elle est modélisée par un point matériel de centre d’inertie G.
Le trajet parcouru par la boîte est divisé en 3
parties :
- une surface horizontale AB. Il s’agit d’un tapis roulant permettant
de faire avancer la boîte de médicament à une vitesse constante v0 = 0,3 m.s-1 ;
- Un plan incliné BC de longueur 1,58 m et formant un angle a = 55°avec l’horizontale. La valeur de la force f modélisant les frottements exercés sur la boîte de médicaments sur cette
portion est f= 0,30N ;
- Une portion de C à D où la boîte est en chute libre, dans un panier au point D.
On néglige l’action exercée par l’air. L’intensité du champ de pesanteur terrestre vaut g = 9,81 N.kg-1.
6. Effectuer le
bilan des actions modélisées par des forces s’exerçant sur la boîte de
médicaments sur les différents trajets entre A et D.
Trajet AB : poids et action du support.
Trajet BC : poids, frottement et action du support.
Trajet CD : poids ( chute libre).
7. Que peut-on dire des forces s’exerçant sur la boîte entre les points A et B ?
Le mouvement étant rectiligne uniforme, les forces se neutralisent, se compensent..
8. Sur le trajet BC.
8.1. Schématiser les forces qui s’exercent sur la boîte de médicament, sans souci d’échelle.
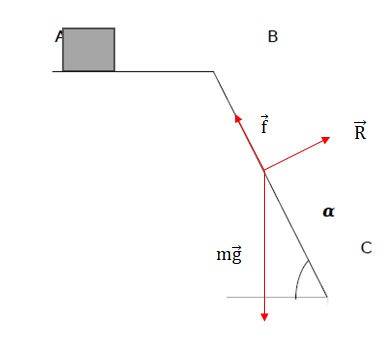
8.2. Donner l’expression littérale du travail de chaque force.
L'action du plan, perpendiculaire au déplacement, ne travaille pas.
Le travail des frottements est résistant : - f BC.
Le travail du poids est moteur : mg BC sin a.
8.3. En utilisant le théorème de l’énergie cinétique, donner l’expression littérale de la vitesse vC de la boîte de médicaments lorsqu’il arrive en C puis calculer sa valeur.
½mvC2 - ½mv02 = -f BC +mg BC sin a.
vC2 = v02 + 2 BC [ -f / m +g sin a ] .
vC = [ v02 + 2 BC [ -f / m +g sin a ] ]½.
vC = [ 0,32 + 2 *1,58 [ -0,30 / 0,3 +9,81 sin 55 ] ]½ ~4,7 m /s.
9. La
boîte est réceptionnée dans un panier situé à un hauteur h sous le
point C. Indiquer, sans faire de calculs, les paramètres sur lesquels
on peut jouer pour que la boîte de médicament ne soit pas déformée à la
réception.
Diminuer l'angle a, augmenter les frottements, diminuer théoriquement BC et h.
|
|
|