Physique
chimie, un drone pour ausculter la couverture végétale,
goût et couleur du sirop de menthe.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Un drone
pour ausculter la couverture végétale.
Les
drones, d’une technologie simple et peu coûteuse, sont utilisés dans le
domaine de la télédétection par les agriculteurs et l’ONF (Office
National des Forêts) pour le suivi du couvert végétal. Le procédé
consiste à analyser la lumière réfléchie par les végétaux en les
survolant pour connaître, entre autres, leur état de santé. L’activité
plus ou moins importante de la photosynthèse est un bon indicateur du
cycle de vie du végétal. Le profil spectral obtenu permet également
d’apporter des éléments d’analyse précieux et de dresser rapidement des
cartographies de grandes étendues végétales.
Partie 1 : étude du vol du
drone.
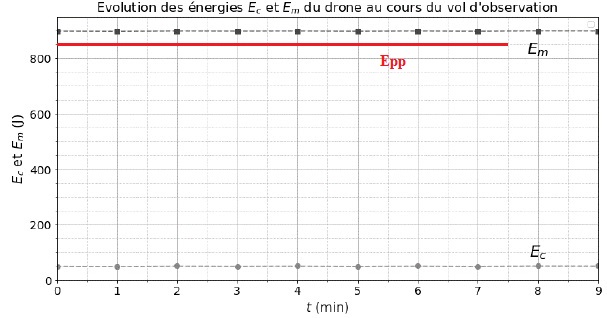
Les courbes présentées ci-dessous montrent l’évolution des énergies
cinétique Ec et mécanique Em du drone lors d’un
vol
d’observation rectiligne. Localement, l’intensité de la pesanteur
g a une valeur voisine de 10 N·kg-1.
1.1 Qualifier le
mouvement du drone. Justifier la réponse.
L'énergie mécanique et l'énergie cinétique sont constante. Il en est de
même de l'énergie potentielle de pesanteur Epp = Em-Ec.
Le mouvement est rectiligne uniforme.
1.2 Montrer, sans
calcul, que l’altitude de vol du drone h est constante.
Epp = Em-Ec =
constante = mgh. Donc l'altitude h est constante.
Ces représentations
graphiques ont été obtenues grâce au programme en langage Python
présentéci-dessous
et à partir des relevés du temps de vol, de la vitesse d’évolution du
drone et de son altitude lors du vol d’observation. Une partie du
script est volontairement cachée et manquante.
1.3 Repérer le
numéro de la ligne du programme où apparaît la masse m du drone puis
noter la valeur de m avec son unité.

1.4 En s’aidant des
représentations graphiques, calculer l’altitude de vol du drone.
L’énergie potentielle de pesanteur Epp est considérée nulle
au niveau du sol.
Aide au calcul : 850 / 7,00 ~ 121 ; 900 / 7,00 ~129 ; 7,00 / 850 ~8,24
10-3 ; 7,00 / 900 ~7,78 10-3.
Em = 900 J ; Ec = 50 J ; Epp = 900-50
= 850 J.
h = 850 / (mg) = 850 / (0,7 x10) = 850 / 7 ~ 121 m.
1.5 Sur le
programme, écrire, à la bonne place, l’instruction permettant de
calculer l’énergie potentielle de pesanteur puis celle
permettant sa représentation graphique.
1.6 Tracer la
courbe représentant l’évolution de l’énergie potentielle de pesanteur
du drone au cours du vol sur le graphique.
Voir ci-dessus.
|
|
Lors
d’un vol rectiligne en palier (altitude fixe) à vitesse constante, on
considère qu’un drone à ailes est soumis à quatre actions mécaniques
modélisées par les forces suivantes : le poids P du drone, la force de
propulsion F, la traînée totale T
qui s’oppose au déplacement et la portance R générées par la
circulation de l’air autour de l’avion. On peut se référer
au schéma ci-après.

(d’après
https://www.drone-academy.fr/reglementation-drones-ailes-volantes/)
1.7 À partir de la
première loi de Newton appliquée au drone durant le vol rectiligne en
palier, montrer que l’intensité F de la force de propulsion est égale à
l’intensité T de la traînée totale.
Partie 2 : analyse de la
lumière réfléchie par la couverture végétale.
La lumière incidente reçue par un végétal est partiellement absorbée,
transmise et réfléchie. La part de lumière réfléchie est analysée par
un spectrophotomètre qui permet d’obtenir le « profil spectral du
végétal ». Les courbes du document ci-dessous représentent la
proportion de
lumière réfléchie par rapport à la lumière incidente (réflectance) en
fonction de la longueur d’onde λ.
La signature spectrale des feuilles dans le visible (longueur d’onde
comprise environ entre 400 nm et 800 nm) reflète l’activité
chlorophyllienne. Dans la partie du proche infrarouge (longueur d’onde
comprise environ entre 800 et 3000 nm environ), la réflectance dépend
de l’état de la
structure interne des cellules de la feuille.
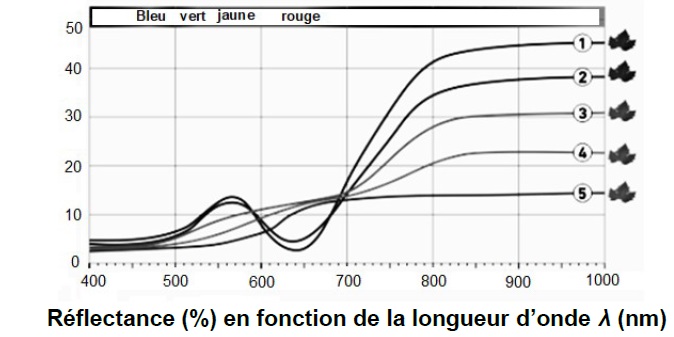
1 : Feuille saine et en pleine activité ;
2 : Stress du végétal ;
3 : Stress important : la chlorophylle a subi une importante
dégradation ;
4 : Chlorophylle fortement dégradée : la récupération du végétal est
impossible ;
5 : La feuille du végétal est morte.
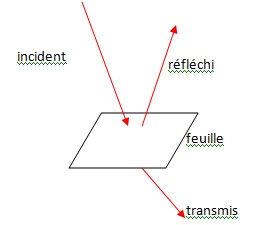
2.1 Schématiser la
feuille d’un végétal et légender avec les mots clés suivants : lumière
réfléchie, lumière incidente et lumière transmise.
2.2 Quelles
longueurs d’onde situées dans le visible la feuille d’un végétal sain
réfléchit-elle ? Quelle est la couleur associée ?
Entre 540 et 600 nm ( vert jaune) ; entre 700 et 800 nm (rouge).
2.3 Quel
rayonnement n’appartenant pas au domaine du visible est également
réfléchi ?
Entre 800 et 1000 nm ( proche infrarouge)
2.4 Justifier
l’installation sur le drone de capteurs sensibles aux longueurs d’onde
550 nm et 880 nm.
Le drone analyse la lumière réfléchie par le végétal. Les longueurs
d'onde correspondantes appartiennent au domaines 540 - 880 nm. Au delà
de 880 nm, les courbes présentent un plat, qui n'apporte pas de
renseignement supplémentaire. En deçà de 500 nm, les courbes sont
pratiquement identiues et ne donnent pas de renseignement sur l'état du
végétal.
|
Goût et couleur du sirop de menthe.
1. Goût de menthe : le menthol et ses dérivés
Le menthol tire son nom de l’essence de menthe. C’est un composé
qui est utilisé fréquemment dans les industries agroalimentaire,
pharmaceutique et cosmétique.
La menthone, qui entre dans la composition de certains parfums et
arômes naturels, est obtenue par oxydation en milieu acide du menthol.
L’éthanoate de menthyle, présent dans l’huile essentielle de menthe,
contribue à l’odeur et au goût de la menthe poivrée. Il peut être
obtenu à partir d’acide éthanoïque et de menthol.
1.1. Indiquer les familles de composés auxquelles appartiennent le menthol, la menthone. Justifier.
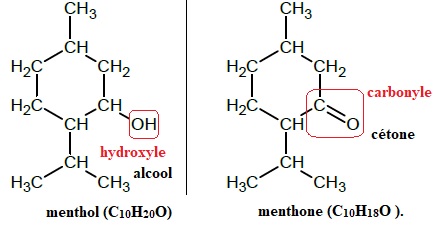
1.2. La menthone peut être obtenue au laboratoire par oxydation du menthol par le trioxyde de chrome CrO3.
Écrire la demi-équation électronique associée au couple menthone /
menthol et justifier que le terme d’oxydation pour le passage du
menthol à la menthone.
C10H20O ---> C10H18O + 2H++2e-.
Le menthol cède des électrons, c'est un réducteur qui s'oxyde.
1.3. Synthèse de l’éthanoate de menthyle à partir d’acide éthanoïque et de menthol.
L’équation de la réaction modélisant la synthèse est la suivante :
C10H20O + C2H4O2 → C12H22O2 + H2O
Protocole de synthèse en laboratoire :
- étape 1 : verser dans un ballon 15,6 g de menthol, puis, avec
précaution, 11,0 mL d’acide éthanoïque pur, et enfin, quelques gouttes
d’acide sulfurique concentré ;
- étape 2 : chauffer à reflux le mélange réactionnel durant 40 minutes environ ;
- étape 3 : verser le mélange obtenu dans un bécher contenant 100 mL de solution aqueuse de chlorure de sodium ;
- étape 4 : extraire la phase organique contenant l’éthanoate de menthyle à l’aide d’une ampoule à décanter ;
- étape 5 : laver la phase organique avec une solution saturée d’hydrogénocarbonate de sodium, on observe une effervescence ;
- étape 6 : agiter prudemment quelques instants en dégazant régulièrement, puis éliminer la phase aqueuse ;
- étape 7 : sécher la phase organique avec du sulfate de magnésium anhydre.
1.3.1. Justifier le nom de l’acide éthanoïque.
Deux atomes de carbone : chaîne carbonée de l'éthane.
Présence d'un groupe carboxyle. Remplacer le e terminal du mot éthane par la terminaison "oïque". Ajouter acide devant le nom.
1.3.2. Indiquer l’intérêt d’utiliser un chauffage à reflux durant la synthèse.
On accélère la réaction ( la température est un facteur cinétique) tout
en évitant les pertes de matière ( les vapeurs se condensent dans le
réfrigérant et retombent dans le milieu réactionnel ).
1.3.3. Expliquer la très forte miscibilité de l’acide éthanoïque avec l’eau.
La présence du groupe carboxyle confère un caractère polaire à la
molécule d'acide éthanoïque. L'eau est également un solvant polaire.
1.3.4. Justifier la présence de deux phases dans le bécher à l’issue de l’étape 3 du protocole.
L'éthanoate de menthyle est très peu soluble dans l'eau et encore moins dans l'eau salée.
1.3.5. Montrer que le menthol est le réactif limitant.
Quantité de matière de menthol : n = 15,6 / M(menthol) = 15,6 / 156 = 0,10 mol.
n(acide éthanoïque) = 11 x masse volumique / M(acide éthanoïque) = 11 x 1,05 / 60 ~ 0,19 ( excès).
1.3.6. À la fin de la synthèse on a obtenu un volume égal à 13 mL d’éthanoate de menthyle. Déterminer le rendement de la réaction.
Masse éthanoate de menthyle : 13 x masse volumique =13 x0,92 = 11,96 g.
Puis diviser par la masse molaire de l'éthanoate de menthyle : 11,96 / 198 ~0,060.
On peut espérer obtenir au mieux 0,10 mol d'éthanoate de menthyle à partir de 0,10 mol de menthol.
Rendement = quantité de matière réelle / quantité de matière théorique = 0,060 / 0,10 =0,60 ( 60 %).
2. Couleur du sirop : dosage du bleu patenté .
Dans de nombreux sirops commerciaux la couleur verte est obtenue en
mélangeant deux colorants couramment utilisés dans l’industrie
agroalimentaire : la tartrazine (E102) et le bleu
patenté V (E131). L’Autorité européenne de sécurité des aliments
conseille que la consommation de bleu patenté V reste inférieure à 5
mg/kg de masse corporelle par jour pour toute catégorie de population
(enfants, adultes, séniors).
http://www.efsa.europa.eu/fr/efsajournal/pub/2818.
Pour déterminer le risque de dépasser cette recommandation européenne,
on se propose d’effectuer un dosage du bleu patenté V dans un sirop
commercial.
On prépare l’échelle de teinte suivante à partir d’une solution mère de bleu patenté V, notée S0, de concentration en masse égale à 16 mg∙L-1.
On mesure l’absorbance de chaque solution à la longueur d’onde 630 nm
où seul le bleu patenté V absorbe. Après modélisation, on obtient le
graphique représentant l’absorbance A en
fonction de la concentration en masse Cm en mg∙L-1 :
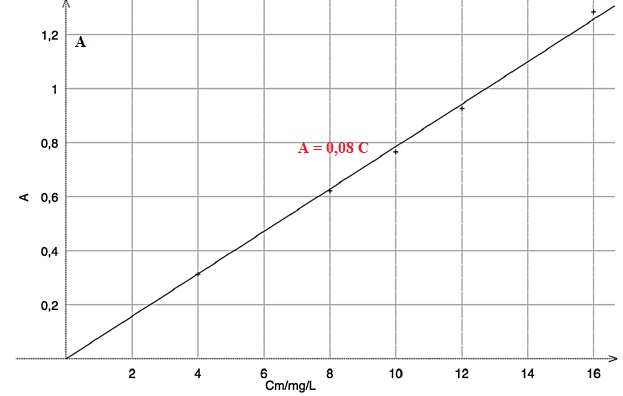
Le fabricant de sirop conseille de diluer 7 fois le sirop (on ajoute de
l’eau au sirop jusqu’à obtenir un volume 7 fois plus important que le
volume du sirop pur) pour une dégustation
optimale. La mesure de l’absorbance à 630 nm du sirop dilué 7 fois est égale à A = 0,512.
2.1. En déduire la concentration en masse en bleu patenté V du sirop dilué.
0,512 / 0,08 = 6,4 mg / L.
2.2. Pour une
personne de 60 kg, déterminer le volume maximal de sirop dilué qu’elle
peut ingérer en suivant la recommandation de l’Autorité européenne de
sécurité. Conclure.
Concentration du sirop non dilué en bleu patenté : 6,4 x 7 =44,8 mg / L.
Diviser par la masse de la personne : 44,8 / 60 ~0,75 mg/ L / kg.
Volume de siropn consommable par jour : 0,75 V = 5 mg / kg ; V = 5 / 0,75 ~6,7 L ( cela est très peu probable ).
|
|
|






