Chimie
des nuages et acidité des eaux de pluies,
concours général 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
La présence d'acide carbonique H2CO3
aq conduit à une eau de pluie dont le pH est naturellement égal à
environ 5,6. L'acidification supplémentaire des eaux de pluie provient
d'une pollution atmosphérique locale ( pollutions à NOx, SO2). Dans cette partie on s'intéresse au mécanisme d'acidification d'une eau de pluie au dioxyde d'azote NO.2(g). Le .
signifie que cette molécule est un radical, c'est à dire qu'elle
possède un électron célibataire lui conférant une grande réactivité. Le
diazote gazeux est transformé en acide nitrique dans l'atmosphère
suivant deux mécanismes ayant lieu en phase gazeuse, l'un se déroulant
le jour, l'autre la nuit.
De jour : NO.2(g) +HO.(g) + M -->HNO3(g) + M.
De nuit : NO.2(g) +NO.3(g) + M -->N2O5(g) + M.
N2O5(g) +H2O(g) --> 2HNO3(g).
M est une impureté. On s'intéresse par la suite à la formation d'acide nitrique de jour.
Formation du radical hydroxyde dans l'atmosphère.
La formation d'acide nitrique de jour met en jeu le radical hydroxyde HO.(g) qui se forme à partir de l'ozone O3 (g) selon :
O3(g) ---> O2(g) + O.(g) sous l'action de la lumière.
O.(g)+H2O(g) ---> 2HO.(g)
32. Représenter le schéma de Lewis du radical HO.(g) et expliquer sa grande réactivité.

La présence d'un électron libre confère au radical hydroxyle une grande réactivité.
33. Quel est l'effet de l'absorption d'un photon par une molécule d'ozone ?
L'une des deux liaisons covalentes est rompue de façon homolytique ( chaque atome garde un électron).
34. L'énergie molaire de liaison entre deux atomes de la molécule d'ozone est E = 390 kJ / mol.
Déterminer une condition sur la longueur d'onde l
de la lumière interagissant avec la molécule d'ozone pour que ce
mécanisme réactionnel puisse avoir lieu. A quel dommainne du spectre
électromagnétique appartient cette radiation ?.
E = hc / l ; l = hc / E avec E = 390 103 / (6,02 1023) =6,48 10-19 J.
l =6,64 10-34 x 3,00 108 / (6,48 10-19) =3,07 10-7 m ( domaine UV).
35. Interpréter l'évolution temporelle de la concentration des radicaux hydroxyle.
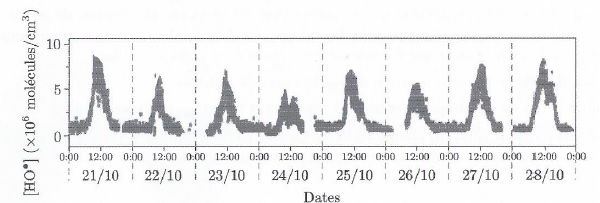
On observe un pic vers 12 H : présence de lumière UV le jour et absence de lumière UV la nuit.
36. Estimer la concentration moyenne ( mol / L) en radicaux hydroxyle à 12 h.
6 10 6 molécules par cm3.
6 10 6/ (6,02 1023 )~1x 10-17 mole par cm3.
1x 10-17 x 1000 = 1 x10-14 mole par dm3.
Cinétique de formation d'acide nitrique atmosphérique en journée.
NO.2(g) +NO.3(g) + M -->N2O5(g) + M.
Les mesures expérimentales montrent que ce mécanisme conduit à un taux de transformation moyen de NO.2(g) sur une journée de plusieurs pour cent par heure.
37. Proposer une interprétation du rôle de M dans cette étape.
Les espèces se trouvent adsorbées à la surce de M qui joue le rôle de catalyseur.
38. Donner l'expression de la vitesse volumique v de disparition à la date t de NO.2(g) en fonction de d[NO.2(g)](t) / dt.
v = - d[NO.2(g)](t) / dt.
On modélise la loi de vitesse par une loi d'ordre 1.
v = k [NO.2(g)] [HO.(g)] avec k = 3,8 1011 mol-1 L min-1 la constante de vitesse.
39. En supposant que [HO.(g)] est constante, égale à sa valeur à 12 h, déterminer l'expression de [NO.2(g)]. On notera [NO.2(g)]0 la concentration initiale en NO.2(g).
On pose k' = k [HO.(g)] = 3,8 1011 x 10-14 =3,8 10-3 min-1.
k' [NO.2(g)] =- d[NO.2(g)] / dt.
d[NO.2(g)] / [NO.2(g)] = -k' dt.
ln[NO.2(g)] = -k't + cste.
ln[NO.2(g)]0 =cste ; ln([NO.2(g)] / [NO.2(g)]0 )= -k't.
[NO.2(g)]=[NO.2(g)]0 e-k't.
40. Déterminer l'expression du temps de demi réaction et calculer sa valeur.
ln(0,5 )= = -ln 2 -k't½ ; t½ = ln(2) / k' = ln(2) / (3,8 10-3 )=1,8 102 min ~ 3 heures.
41. Calculer le taux de transformation à 12 h de NO.2(g en acide nitrique en pourcentage par heure. Commenter.
([NO.2(g)]0 -NO.2(g)t = 60 / [NO.2(g)]0 = 1-e-60 k' =1-0,8 = 0,2 ( 20 %).
Cette valeur est bien supérieure à quelques pour cent.
L'hypothèse [HO.(g)] est constante, n'est pas valide. [HO.(g)] est maximale à 12 h mais diminue rapidement en cours de journée.
|
...
|
....
|
Titrage d'une eau de pluie
Une
eau de pluie de pH = 4,8 est prélevée au voisinage d'un site où l'on
soupçonne une pollution à l'azote à cause d'un rejet de NO.2(g) important. On réalise un dosage de V0 = 200 mL d'eau de pluie par une solution de soude à 1,0 10-3 mol / L.
42
. Proposer un protocole expérimental permettant de préparer la solution de soude à partir d'ydroxyde de sodium solide.
Masse de solide à peser pour préparer un lite se cette solution : 1,0 10-3 xMNaOH =1,0 10-3 x40 = 4,0 10-2 g = 40 mg.
Peser 40 mg de solide ( balance de précision tarée+ coupelle)
Verser dans une fiole jaugée de 1,00 L ( entonnoir de coulée) contenant un tiers d'eau distilée.
Agiter jusqu'à dissolution complète du solide.
Compléter avec de leau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
43. Pourquoi est-il utile de titrer la solution de soude avant de l'utiliser ?
Une solution de soude préparée depuis plusieurs jours peut être carbonatée.
44. Réaliser un schéma du montage expérimental permettant de titrer l'eau de pluie.
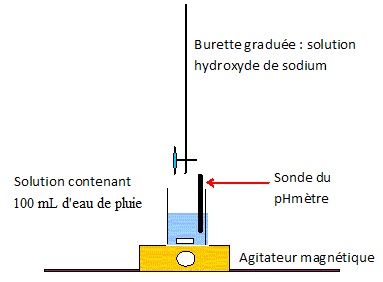
Le pHmètre peut être remplacé par un conductimètre.
Ce titrage est suivi par conductimétrie.
45. Ecrire les équations des réactions qui modélisent la dissolution de l'acide nitrique gaz HNO3(g) et du dioxyde de carbone gazeux dans l'eau.
HNO3(g) + H2O(l) --> H3O+aq + NO3-aq.
CO2(g) + H2O(l) -->H2CO3 aq.
46. Déterminer les formes prédominantes des espèces acides en début du dosage.
A pH = 4,1, H3O+aq et H2CO3 aq prédominent.
47. Ecrire les équations des réactions supports du titrage.
H3O+aq +HO-aq --> 2 H2O(l). (1)
H2CO3 aq+HO-aq -->HCO3-aq +H2O(l). (2)
48.
Déterminer les constantes d'équilibre de chacune de ces
transformations. Expliquer pourquoi ces transformations peuvent être
considérées comme totale.
(1) : K = 1 /( [H3O+aq] [HO-aq] )=1 /10-14 = 1014.
(2) : K = [HCO3-aq] / ([HO-aq][H2CO3 aq]) = [HCO3-aq][H3O+aq] / ([HO-aq][H3O+aq][H2CO3 aq])
K = Ka1 / 10-14 = 10-6,4 / 10-14 =107,6.
Les constantes de réaction étant grandes, les réactions sont totales.
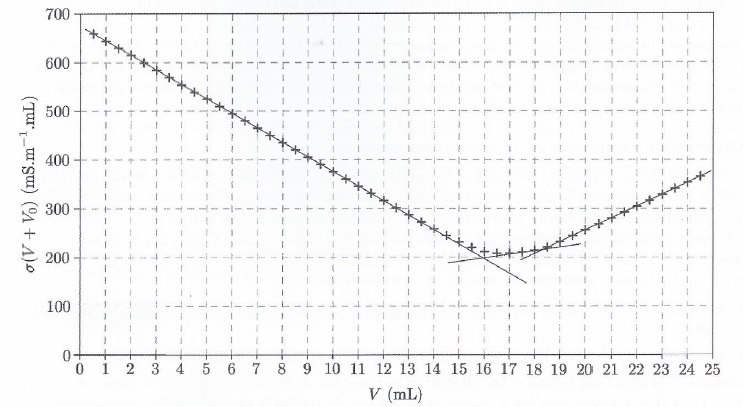
49. Expliquer les changement de pentes observées sur la courbe de titrage.
Dosage de l'acide nitrique :
avant l'équivalence, du point de vue de la conductimétrie, tout se passe comme si on remplaçait l'ion H3O+aq par l'ion Na+aq, de conductivité molaire ionique bien plus faible. La conductivité de la solution décroît entre 0 et 16 mL de soude ajoutée.
Entre 16 mL et 18,5 mL de soude ajoutée, titrage de l'acide carbonique.
Avant l'équivalence, du point de vue de la conductimétrie, tout se passe comme si on remplaçait H2CO3 aq par Na+aq et HCO3-aq.
La conductivité de la solution croît.
Au dela de 18,5 mL de soude ajoutée, on ajoute des ions Na+aq et HO- aq de conductivité molaire ionique grande : la conductivité de la solution croît rapidement.
50. Déterminer les volumes équivalents.
Abscisses des points d'intersection des tangentes : Véq 1 =16 mL ; Véqu 2 = 18,5 -16 = 2,5 mL.
51. Déterminer les concentrations en acide nitrique et en acide carbonique.
[HNO3] = CB Véq 1 / V0 =1,0 10-3 x16 /200 =8,0 10-5 mol / L.
[H2CO3] = CB (Véq 2 -V éq 1)/ V0 =1,0 10-3 x2,5 /200 =1,2 10-6 mol / L.
52. Une eau de pluie présente en moyenne une concentration de 4,8 10-6 mol / L en acide nitrique.
L'eau de pluie titrée est-elle plus polluée que la moyenne ?
Oui : 8,0 10-5 /(4,8 10-6) ~17 fois plus polluée que la moyenne.
|
|



