Chimie,
concours école de santé des armées ESA 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Exercice 6. (4 points)
On
souhaite acheter un litre d'acide sulfurique fumant. l'étiquette
indique : M = 98 g / mol ; densité d = 1,84. Cette solution contient 95
% en masse d'acide sulfurique H2SO4.
QCM 8. (1,5 points).
Indiquer la (les) proposition(s) exacte(s).
Aide : 175 / 98 = 1,78 ; 98 / 175 = 0,56 ; 184 / 98 = 1,87 ; 98 /184 = 0,53.
A. La masse volumique de cette solution vaut 1,84 et ne possède pas d'unité.
1,84 g cm-3.
B. Pour calculer la densité de cette solution on a besoin de connaître la masse volumique de l'air.
Densité d'un gaz par rapport à l'air
= masse d'un volume V du gaz / masse du même volume dair , les volumes
étant mesurés dans les mêmes condition de température et de pression.
C. On peut dire que 1 L de cette solution pèse 1,84 103 g.
Vrai.La masse de 1 L de cette solution est 1,84 kg.
D. Dans 1 L de solution, on trouve 1,84 kg d'acide sulfurique.
1,84 x0,95 ~1,75 kg.
E. La concentration en acide sulfurique de cette solution est de 18,7 mol / L.
1,84 103 x0,95 / 98 = 1,75 103 /98 =175 / 98 x10 ~ 17,8 mol / L.
Le pH a été calculé en prenant comme référence une solution à 49 g / L
d'acide sulfurique ( solution A). Le taux d'avancement de la
réaction acide base qui se déroule dans la solution A vaut 1.
On peut en déduire que :
Aide : log 2 =0,301 ; ln 2 =0,693 ; log 3 = 0,477 ; ln 3 = 1,098.
QCM 9. (0,5 point).
La concentration de la solution A vaut :
A. 0,05 mol / L.
49 / 98 = 0,5 mol / L.
B. 0,5 mol / L. Vrai.
C. 5 10-3 mol / L.
D. 0,2 mol / L
E. Les items ci-dessus sont tous faux.
QCM 10. (1 point).
Indiquer la ( les) proposition(s) juste(s) parmi les items suivants :
A. L'acide sulfurique est un acide fort. Vrai.
Le taux d'avancement est égal à 1.
B. Pour cette solution A, l'équation chimique est : H2SO4 +H2O --> HSO4- +HO-.
C. Pour cette solution A, l'équation chimique est : HSO4- +H3O+ --> H2SO4 +HO-.
H2SO4 +H2O --> HSO4- +H3O+ .
D. L'espèce HSO4- joue le rôle de base. Vrai.
HSO4- est amphotère ; elle peut jouer le rôle de base ou le rôle d'acide.
E. Les items ci-dessus sont tous faux.
QCM 11. (1 point).
Le pH de cette solution A vaut :
A. 0,3. Vrai.
[H3O+ ] = c ; pH = - log ( c) = -log (0,5) = 0,3
B. -0,3.
C. 3.
D. 3,3
E. Les items ci-dessus sont tous faux.
Exercice 7. (4 points )
QCM 12.
Soient les échantillons suivants :
Echantillon 1 : 10 g de dichlore Cl2.
Echantillon 2 : 0,1 mol de dichlore.
Echantillon 3 : 10 g de chlorure de sodium ( NaCl).
Echantillon 4 : 0,1 mol de chlorure de sodium.
A. L'échantillon 1 compore une masse de chlore ( Cl ) plus importante que l'échantillon 3. Vrai.
Echantillon 3 : 10 x 35,5 / (23 +35,5) ~6 g de chlore.
B. L'échantillon 2 compore une masse de chlore ( Cl ) plus importante que l'échantillon 3. Vrai.
Echantillon 2 : 0,1 x(2 x35,5) ~7,1 g.
C. L'échantillon 2 compore une masse de chlore ( Cl ) 2 fois plus importante que l'échantillon 4. Vrai.
Echantillon 4 : 0,1 x35,5 =3,55 g.
D. L'échantillon 4 compore une masse de chlore ( Cl ) moins importante que l'échantillon 1. Vrai.
E. Les items ci-dessus sont tous faux.
Exercice 8. ( 4 points ).
L'hydrolyse d'un composé à 50° donne les résultats suivants :
t (heure)
|
0
|
4
|
8
|
12
|
16
|
24
|
C (mol / L)
|
0,10
|
0,09
|
0,08
|
0,07
|
0,06
|
0,04
|
| ( [A]0-[A]t ) / t= k |
XXX
|
0,0025
|
0,0025
|
0,0025
|
0,0025
|
0,0025
|
| ln( [A]0 / [A]t / t = k |
XXX
|
0,0263
|
0,0279
|
0,0297
|
0,0320
|
0,0382
|
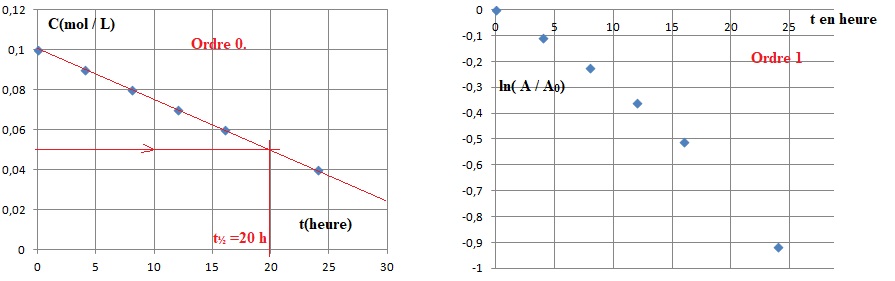
La loi de vitesse peut être soit d'ordre 0, soit d'ordre 1.
Si elle est d'ordre 0, elle se modélise par A --> B ; v = k et [A]t = [A]0-kt.
[A]0 : concentration initiale et k la constante de vitesse.
Si elle est d'ordre 1, elle se modélise par A --> B+C ; v = k [A]t = [A]0e-kt ; ln[A]t =ln [A]0 -kt.
1. Définir le temps de demi-réaction et donner sa valeur.
Le temps de demi réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
t½ ~20 heures.
2. Pour chacune des deux hypothèses, exprimer le temps de demi-réaction en fonction de [A0] et/ou k.
Ordre 0 : [A]t½ = 0,5[A]0 = [A]0-k t½.
t½ =0,5[A]0 / k.
Ordre 1 : ln( 0,5[A]0 )=ln [A]0 -k t½ ; k t½ = ln(2) ; t½ = ln(2) / k.
3. Pour chacune des deux hypothèses, préciser l'unité de la constante de vitesse.
Ordre 0 : [A]t = [A]0-kt. k s'exprime en mol L-1 h-1.
Ordre 1 :ln[A]t =ln [A]0 -kt. k s'exprime en h-1.
4. A partir des résultats de l'énoncé, déterminer quel est l'ordre de la réaction ; en déduire k.
Réaction d'ordre 0 : [A]t = [A]0-kt est une droite de coefficient directeur égal à -k.
k = 0,05 / 20 =2,5 10-3 mol L-1 h-1.
5. Au bout de combien de temps, ce produit est-il hydrolysé ?
[A]0-kt = 0 ; t = [A]0 / k =0,1 / (2,5 10-3) =40 heures.
|
...
|
....
|
Exercice 9. (2,5 points).
Dans un récipient initialement vide de volume V = 5 L, on introduit de l'eau, 5 10-3 mol d'éthanol ( C2H6O) et 5 10-2 mol de propanone ( C3H6O). L'ensemble est porté à 127°C où toutes les espèces sont gazeuses. La pression totale mesurée est PT =96 000 Pa.
Aide : 1 / 18 =0,0556 ; 1 /23 = 0,0435 ; 3 /58 =0,0517.
1 . Enoncer l'équation des gaz parfaits en précisant les unités.
PV = n RT
P pression en pascal, V volume en m3 ; n quantité de matière en mole, T température en kelvin et R ~ 8 J K-1mol-1.
2. Calculer la quantité de matière total nT dans le récipient.
nT = PV /(RT) = 96 000 x5 10-3 /(8 x(127+273)) =96 x 5 /(8 x400)=15 /100 = 0,15 mol.
3. En déduire la masse d'eau.
neau = 0,15 -5 10-3 -5 10-2 =0,095 mol.
m = 0,095 x18 =1,71 g.
Exercice 10. (5,5 points).
Soit
l'acide alpha-aminé Lysine dont on donne une représentation
topologique. La lysine réagit en solution aqueuse suivant les
équilibres acide-base pour donner naissance aux formes I à IV
ci-dessous :
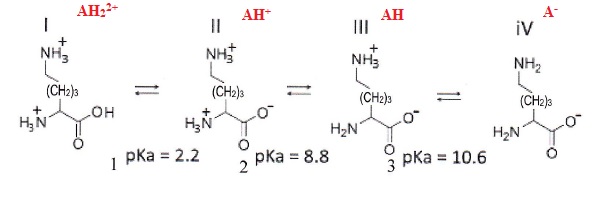
1. Ecrire l'expression de la constante d'acidité Ka1 correspondant à l'équilibre acide-base entre les formes I et II.
Ka1 = [AH+][H3O+] / (AH22+].
2. Exprimer la relation entre pH et pKa1.
log Ka1 =log( [AH+]/ (AH22+]) + log ([H3O+] ).
-log Ka1 = -log( [AH+]/ (AH22+]) - log ([H3O+] ).
pKa1 =pH-log( [AH+]/ (AH22+]).
pH = pKa1 +log( [AH+]/ (AH22+]).
3. La forme
zwitterionique correspond à la forme globalement neutre, donner
l'intervalle de pH pour lequel cette forme est présente.
La forme III est présente entre pH =8,8 et pH = 10,6.
4. Définir une
solution tampon. Comment puis-je en créer une avec de la lysine sachant
que je veux une solution tampon de pH = 10,6 ?
Une solution tampon modère les variations de pH suite à l'ajout d'un
acide fort ou d'une base forte, suite à une dilution modérée.
Réaliser une solution contenant la forme II et la forme III telle que les quantités de matière des deux formes soient égales.
5. Donner la formule brute de la lysine.
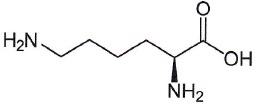
C6H14O2N2.
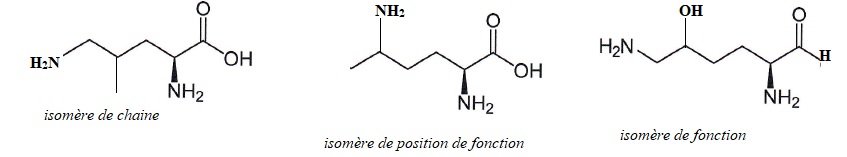
6. Ecrire un isomère de chaine, un isomère de position et un isomère de fonction de la lysine.
|
|