Un
apport de magnésium. Bac général Amérique du Nord 2021.
Dilution, titrage avec suivi pHmétrique
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
On s'intéresse à un médicament comportant du magnésium sous forme d'ion Mg2+
(aq). Le but de cet exercice est de déterminer le nombre de comprimés
de ce médicament qu'un patient pourrait prendre chaque jour pour
compenser ce manque de magnésium.
On réalise un protocole expérimental en deux étapes.
Etape 1. Substitution des ions magnésium dans la résine échanteuse d'ions.
On prépare, par dissolution d'un comprimé du médicament dans une fiole
jaugée, un volume de 250,0 mL d'une solution aqueuse notée S. On
introduit un échantillon de volume V1 = 25,0 mL de solution
S par le haut d'une colonne contenant une résine. Celle-ci est
constituée de billes poreuses saturées en ion oxonium H3O+aq
échangeables. Aucontact de la résine, tous les ions magnésium présents
dans l'échantillon vont s'échanger avec les ions oxonium et prendre
leur place sur la résine. La solution recueillie dans un bécher après
passage dans la résine est appelée l'éluat.
Pour chaque ion magnésium fixé, la résine libère deux ions oxonium.
Etape 2. Dosage par titrage de sions oxonium dans l'éluat.
On dose ensuite, par pH-métrie, les ions oxonium contenus dans l'éluat par une solution d'hydroxyde de sodium.
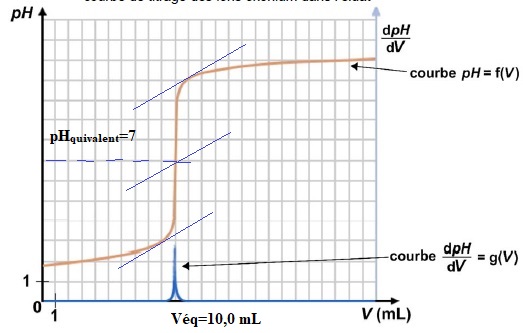
Après traitement numérique des mesures, on obtient le tracé suivant.
La solution d'hydroxyde de sodium de concentration CB = 4,00 10-2 mol / L, utilisée pour le titrage, est obtenue par dilution d'une solution mère S0 de concentration C0 = 0,100 mol / L.
1. Indiquer la verrerie à utiliser pour effectuer cette dilution avec un seul prélevement de S0.
Facteur de dilution F = C0 / CB = 0,100 / (4,00 10-2) =2,5.
Volume de le fiole jaugée = 2,5 x volume de la pipette jaugée.
Par exemple fiole jaugée de 50,0 mL et pipette jaugée de 20,0 mL.
2. Ecrire l'équation de la réaction support du titrage puis définir l'équivalence.
HO-aq + H3O+aq---> 2H2O (l).
A l'équivalence les quantités de matière des réactifs mis en présence, sont en proportions stoéchiométriques.
Avant l'équivalence, H3O+aq est en excès ; après l'équivalence, HO-aq est en excès.
3.
Justifier le choix de l'indicateur coloré.
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent, pH = 7 dans ce cas.
Le bleu de bromothymol convient ( zone de virage 6,0< pH < 7,6).
4.
Montrer que la quantité de matière d'ions oxonium dans l'éluat est égale à 4,0 10-4 mol.
A l'équivalence :
quantité de matière d'ion oxonium = quantité de matière d'ion hydroxyde = CB Véq =4,00 10-2 x 10,0 10-3 =4,00 10-4 mol.
Pour les adultes, le besoin quotidien en magnésium est estimé à 6,0 mg par kilogramme de masse corporelle.
5.
Déterminer le nombre de comprimé de médicament qui apporteraient, à un
adulte en manque de magnésium, la masse de magnésium préconisée par
jour. Comment réduire cette consommation médicamenteuse ?
Dans 25 mL de solution S, il y a 4,0 10-4 mol d'ion oxonium, soit 2,0 10-4 mol d'ion magnésium fixé.
Dans 250mL de S ( soit dans un comprimé) il y a 2,0 10-3 mol d'ion magnésium.
M(Mg) = 24,3 g / mol.
Masse de magnésium dans un comprimé : 24,3 x 2,0 10-3 =0,0486 g ou 48,6 mg.
Pour un adulte de masse corporelle 60 kg, l'apport en magnésium est de : 60 x6 =360 mg.
Soit 360 / 48,6 ~7,4 soit 8 comprimés.
Consommer
davantage d'aliments riches en magnésium : légumes verts, céréales
complètes, noix, noisettes, des légumes secs ( haricots blancs,
lentilles ), chocolat, certaines eaux minérales ( Hépar, Contrex, Badoit ).
|

