L'aquarium
récifal.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
|
1. Régulation de l'acidiité.
Le pH optimal de cet aquarium vaut 8,1. En journée, la photosynthèse
augmente naturellement le pH, qui diminue ensuite pendant la nuit.
1.1- Indiquer ce qui peut être mis en oeuvre si la valeur du pH devient trop faible.
Ajouter une base, par exemple CO32- ou HCO3-.
On peut considérer que l'eau de l'aquarium se comporte comme une solution tampon.
1.2- Citer les propriétés d'une solution tampon. Justifier l'utilisation d'une telle solution dans cet aquarium.
Une solution tampon modère les variations de pH suite à une dilution et suite à l'ajout modéré d'une base ou d'un acide.
Un
diffuseur permet de réguler précisément la valeur du pH en injectant au
besoin du dioxyde de carbone à l'état gazeux dans l'aquarium. Le
dioxyde de carbone se dissout faiblement dans l'eau. Il peut alors se
dissocier partiellement en ion hydrogénocarbonate et en ion carbonate.
On donne les schéma de Lewis de CO2 et de H2O.
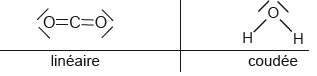
1.3- Justifier la faible solubilité du dioxyde de carbone dans l'eau.
L'eau est une molécule polaire. Le dioxyde de carbone n'est pas
polaire, il est donc peu soluble dans un solvant polaire comme l'eau.
1.4. Indiquer parmi les espèces acido-basiques associées à CO2 dissous, celles qui sont des acides de Brönsted et celles sui sont des bases de Brönsted.
Acide : CO2, H2O et HCO3-.
Base : HCO3-. et CO32-.
1.5- Parmi ces espèces que est (sont) celle(s) qui prédomine(nt) dans l'aquarium.
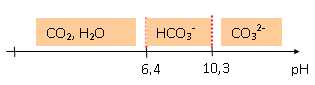 Au pH optimal 8,1, HCO3- prédomine.
Au pH optimal 8,1, HCO3- prédomine.
1.6. Expliquer pourquoi l'utilisation d'un diffuseur de CO2 dans l'aquarium peut freiner la formation du squelette et de la coquille des coraux.
En injectant du dioxyde de carbone dans l'eau, le pH de celle-ci diminue et en conséquence la concentration en ion CO32- diminue.
Or le squelette des coraux est du carbonate de calcium CaCO3(s).
L'équilibre suivant est en conséquence déplacé vers la gauche, dissolution de CaCO3(s).
Ca2+aq + CO32-aq =CaCO3(s).
|
Contrôle de salinité.
La salinité de l'eau de l'aquarium est assimilée à la concentration en
masse en ion chlorure. Elle doit être comprise entre 19,3 et 19,6 g / L.
On se propose de titrer les ions chlorures. On prélève de l'eau de
l'aquarium que l'on dilue 10 fois, puis on titre 10,0 mL de cette
solution à laquelle on a ajouté 200 mL d'eau ditillée, par une solution
de nitrate d'argent de concentration 5,00 10-2 mol / L. Le titrage est suivi par conductimétrie.
Ag+aq +Cl-aq --> AgCl(s).
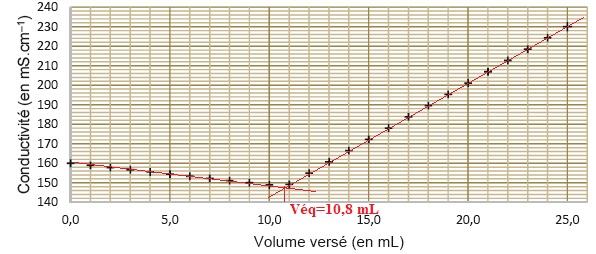
2.1- Justifier qualitativement l'allure de la pente de la courbe.
Avant l'équivalence Ag+aq
est en défaut : du point de vue de la conductivité, tout se passe comme
si on remplaçait l'ion chlorure par l'ion nitrate de conductivité
molaire ionique moindre : la conductivité de la solution décroît.
Après l'équivalence, Ag+ est en excès et on ajoute des ions nitrate : la conductivité de la solution croît rapidement.
2.2- Un traitement de l'eau est-il nécessaire ?
Quantité de matière d'ion chlorure à l'équivalence : n = 10,8 x5,00 10-2 =0,54 mmol.
Prendre en compte la dilution au dixième : 0,54 x10 = 5,4 mmol dans 10 mL soit 0,54 mol / Ld'ion chlorure.
Titre massique en ion chlorure : 35,5 x 0,54 ~19,2 g/L.
Cette valeur n'étant pas comprise entre 19,3 et 19,6 g / L, un traitement est nécessaire.
Traitement des poissons contre les vers.
Le praziquantel entre dans la composition d'un vermifuge liquide, de concentration 10,0 g / L.
Etape 2 de la synthèse du praziquantel.
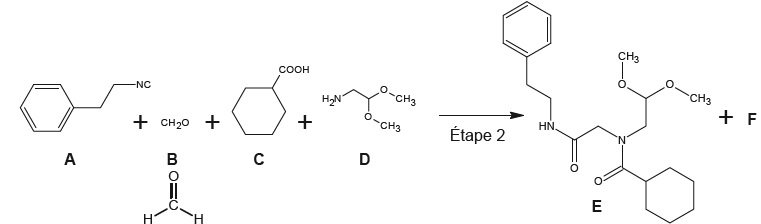
3.1.1- Justifier que B est le méthanal.
Un seul atome de carbone et une fonction aldehyde : on remplace le "e" du mot méthane par "al".
3.1.2. Donner la formule semi développée, puis brute de C.
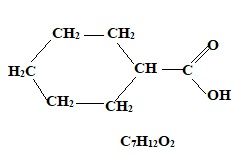
3.1.3. Déterminer le produit F. H2O.
La synthèse de 40,9 g de E nécessite 0,110 mol de chacun des réactifs A, B, C et D. M(E) = 376,5 g/mol.
3.1.4- Déterminer le rendement de l'étape 2.
Masse théorique : 0,110 x 376,5 = 41,415 g.
Rendement = masse réelle / masse théorique = 40,9 / 41,415 ~0,988. ( 98,8 %).
3.2- L'étape 3 nécessite l'utilisation d'acide méthylsulfonique noté AMS. Quatre opérations sont nécessaires.
b. La solution est extraite 4 fois avec de l'éther diéthylique.
c. La phase organique est lavée avec 100 mL d'eau salée saturée,
puis séchée. Après évaporation de l'éther on obtient un solide jaune.
3.2.1. Associer à ces deux opérations un ou plusieurs mots suivants :
dissolution, séparation, purification, transformation chimique.
Etape b : séparation des phases aqueuse et organique.
Etape c : relargage des espèces organiques de la phase aqueuse vers la phase organique. Purification de la phase organique.
3.2.2. Nommer une méthode d'identification possible pour le solide obtenu.
Mesure du point de fusion.
Prévention des infections.
On utilise une solution antiseptique de bleu de méthylène,
colorant faiblement biodégradable, de couleur bleu foncé. L'excès est
éliminé par des filtres à charbon actif.
Le charbon actif est une poudre noire dont les pores permettent de fixer les molécules organiques.
4.1. Justifier l'intérêt de l'étape de filtration.
Elimination de l'excès de bleu de méthylène piégé dans le charbon actif.
La capacité d'absorption du charbon actif peut être évaluer par un dosage par étalonnage.
Les valeurs d'absorbance obtenues avant et après traitement de l'eau pour éliminer l'excès de bleu de méthylène sont Apolluée = 1,5 et Atraitée = 0,2.
4.2. Montrer que la masse ma de colorant adsorbée par gramme de charbon actif est voisine de 7 mg.
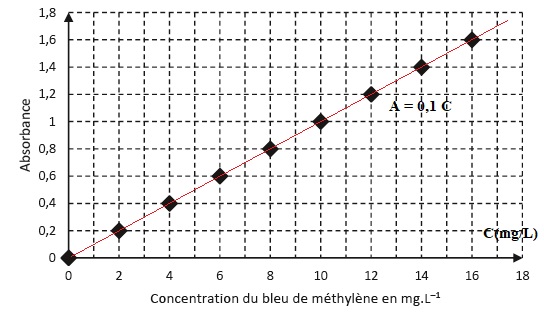
Eau polluée au bleu de méthylène : C = Apolluée / 0,1 =15 mg / L.
Soit dans 50,0 mL d'eau : 15 x0,050 =0,75 mg.
Eau traitée : C =Atraitée / 0,1 = 2 mg / L.
Soit dans 50,0 mL d'eau : 2 x0,050 =0,10 mg.
Bleu de méthylène éliminé par 100 mg= 0,10 g de charbon actif : 0,65 / 0,10 =6,5 mg par g de charbon actif.
4.3. Un
traitement préventif de l'aquarium ( V = 8000 L) nécessite 1 à 2 mg de
bleu de méthlène par litre d'eau, calculer la masse de charbon actif
nécessaire. Commenter.
8 à 16 g de bleu de méthylène pour 8000 L d'eau.
Dans l'hypothèse où il faut éliminer 8 g de bleu de méthylène : 8000 / 7 =1,1 103 g=1,1 kg de chabon actif.
Cette masse reste faible. Cette opération est tout à fait réalisable.
|
|





