Dépolluer
une eau avec des carapaces de crevettes,
bac général 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
...
|
|
L'objectif
de cet exercice est d'étudier la transformation de la chitine en
chitosanepuis d'analyser l'action du chitosane pour le traitement d'une
eau polluée par des ions métalliques.
1. De la chitine au chitosane.
On donne la formule topologique d'une macromolécule de chitine. composée de 4 motifs.
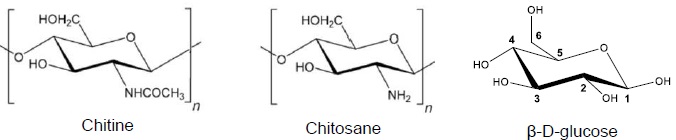
1. Indiquer si la chitine est un polymère naturel ou artificiel Justifier. Même question pour le chitosane.
La chitine est un polymère naturel ; le chitosane est un polymère artificiel.
La
chitine est l’un des constituants principaux de l’exosquelette des
crustacés, des animaux à coquilles et des insectes. Elle est le
deuxième polysaccharide le plus répandu dans la nature, après la
cellulose. Cependant, la chitine est soluble dans très peu de solvants,
ce qui limite ses applications. C’est pourquoi, on la transforme
chimiquement en chitosane.
2. Entourer le motif de la chitine.
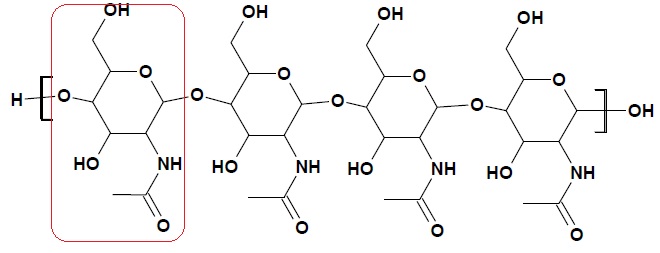
2. Protocole expérimental pour la synthèse du chitosane à partir de la chitine.
- Introduire 8,0 g de chitine dans un ballon de 250 mL et ajouter 100
mL d'une solution aqueuse d'hydroxyde de sodium très concentrée.
- Chauffer à reflux pendant une heure.
- Filtrer sur bûchner puis rincer avec de l'eau distillée jusqu'à l'obtention d'un pH neutre pour le filtrat.
- Sécher et peser le produit obtenu.
4,0 g de chitosane, solide blanc sont obtenus.
Cette transformation est modélisée par la réaction suivante :
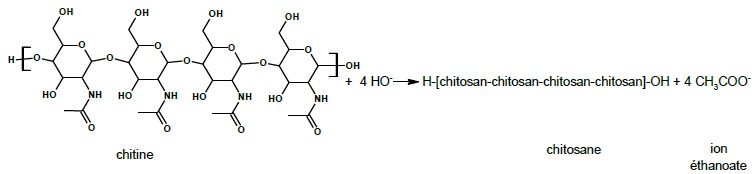
20.1. Représenter la formule topologique du motif du chitosane.
2.2. Nommer la famille fonctionnelle correspondant au groupe caractéristique formé dans le chitosane.
Famille des amines primaires R -NH2.
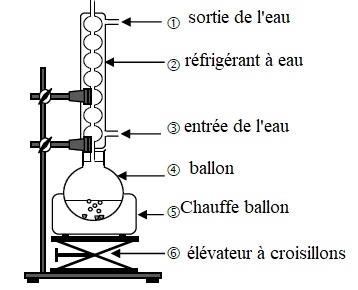
2.3. Après avoir expliqué l'intérêt du montage à reflux, nommer les éléments du montage.
La température est un facteur cinétique.
Ce
montage augmente la vitesse d'une réaction lente en travaillant à
température modérée. On évite les pertes de matière : les vapeurs se
condensent dans le réfrigérant et retombent dans le ballon.
2.4 Définir puis calculer le rendement de la synthèse, les ions hydroxyde étant introduit en excès.
Quantités de matière :
n(chitine) = masse (g) / M(chitine) =8,0 / 203 =0,0394.
nthéorique ( chitosane) =0,0394 mol.
Masse théorique chitosane : 0,0394 M(chitosane) = 0,0394 x 159 =6,27 g.
Rendement = masse réelle / masse théorique = 4,0 / 6,27 ~0,64 (64 %).
3. Du chitosane pour dépolluer.
Le chitosane peut être utilisé comme un agent de dépollution de
solutions aqueuses contenant des ions métalliques, par exemple Cu2+aq. Il se forme une espèce chimique complexe notée [Cu( chitosane)]2+. Ce complexe forme un précipité avec les ions sulfate et peut ainsi être séparé du reste de la solution.
Cu2+aq + chitosane ---> [Cu( chitosane)]2+.
La détermination du taux d'avancement final permet d'évaluer l'efficacité de la dépollution.
Protocole de traitement des ions cuivre (II) :
- Introduire 1,5 g de chitosane solide dans un becher contenant 40 mL d'une solution aququse S0 de sulfate de cuivre de concentration c0 = 0,10 mol / L. Le chitosane est en excès.
- Agiter 30 minutes, filtrer et mesurer l'absorbance du filtrat.
La concentration finale cf des ions cuivre (II) est déterminée grâce à un dosage par étalonnage.
Préparation de la gamme de solutions étalons.
Les solutions filles sont obtenues par dilution de la solution mère. de concentration cs = 0,50 mol / L. l'absorbance des 6 solutions est mesurée à la longueur d'onde de 790 nm. Cu2+aq est la seule espèce qui absorbe à cette longueur d'onde.
solution
|
1
|
2
|
3
|
4
|
5
|
6
|
filtrat
|
concentration ( mol/L) Cu2+.
|
0,10
|
0,050
|
0,040
|
0,030
|
0,020
|
0,010
|
cf
|
A
|
1,13
|
0,58
|
0,44
|
0,34
|
0,23
|
0,11
|
0,30
|
3.1. Indiquer la couleur d'une solution aqueuse de sulfate de cuivre (II).
La solution présente un maximum d'absorption vers 790 nm ( rouge). La
solution possède la couleur complémentaire du rouge, soit le cyan.
3.2. Décrire un protocole de dilution permettant d'obtenir 10,0 mL de la solution "1" à partir de S.
Facteur de dilution : 0,50 / 0,10 = 5.
Dans une fiole jaugée de 10,0 mL contenant 1 /3 d'eau distillée,
ajouter 10,0 / 5 = 2,0 mL de solution mère prélevés à la pipette jaugée
de 2,0 mL. Compléter jusqu'au trait de jauge avec de l'eau distillée.
Agiter pour rendre homogène.
3.3. Montrer que le taux d'avancement final de la complexation des ions Cu2+aq est égal à 0,73. Conclure et proposer, le cas échéant, une méthode pour améliorer cette efficacité.
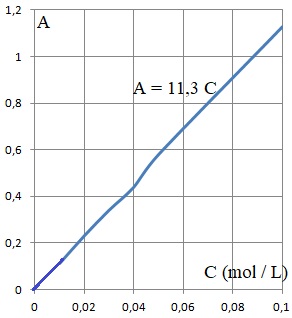
Cf = 0,30 /11,3 ~ 0,0265 mol / L.
Taux d'avancement final : ( 0,10 -0,0265) / 0,10 ~ 0,73.
Ce taux d'élimination reste insuffisant. Remplacer la poudre par un film de chitosane améliore l'élimination des métaux lourds.
|
|
4. Etude cinétique de la complexation des ions Cu2+ par le chitosane.
A
la date t=0, on introduit un film de chitosane dans une solution
aqueuse de sulfate de cuivre (II). On détermine la concentration des
ions Cu2+ aq à différentes dates.
4.1. Définir la vitesse volumique de consommation des ions Cu2+ aq.
La vitesse volumique de consommation des ions Cu2+ aq correspond à la quantité de matière d'ion cuivre (II) disparue par unité de temps et de volume.
L'évolution temporelle de la concentration C des ions Cu2+ aq est représentée ci-dessous.
4.2. Estimer la valeur de la vitesse volumique de consommation des ions Cu2+ aq à la date t = 10 min par une construction graphique.
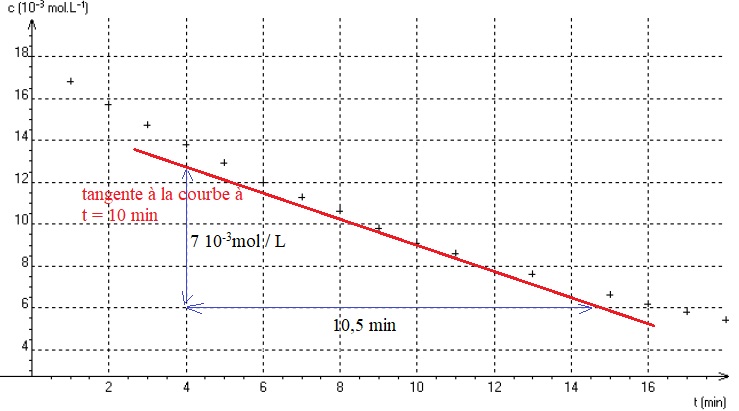
Valeur absolue du coefficient directeur de la tangente à la courbe à t = 10 min : 7 10-3 / 10,5 ~6,7 10-4 mol L-1 min-1.
4.3 Décrire l'évolution de cette vitesse au cours du temps. Proposer un facteur cinétique à l'origine de cette évolution.
Les tangentes à la courbe C = f(t) sont de moins en moins inclinées par
rapport à l'horizontale. La valeur absolue de leur coefficient
directeur, vitesse volumique de la réaction, diminue.
La concentration en ion Cu2+aq, facteur cinétique, diminue au cours du temps.
On souhaite savoir si l'évolution de la vitesse volumique de consommation en ion Cu2+aq
peut être modélisée par une loi d'ordre 1. Le programme suivant permet
de calculer les vitesses volumiques au différentes dates, puis de
représenter l'évolution de cette vitesse en fonction de la
concentration en ion Cu2+aq.
Une partie du programme permet de modéliser les résultats par une fonction affine.
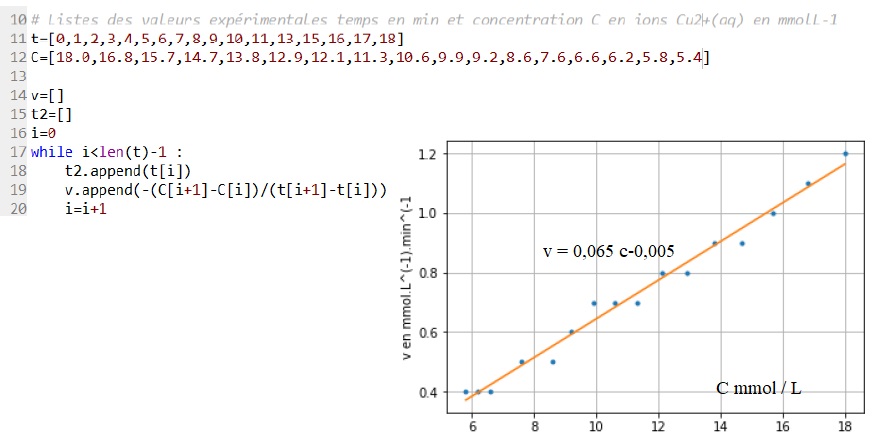
4.4. Expliquer pourquoi le calcul des vitesses volumiques de consommation des ions Cu2+ aq, réalié par ce programme, est une valeur approchée.
Le programme calcule des vitesses moyennes sur des intervalles de temps
d'une minute et donne donc une valeur approchée de la vitesse volumique.
4.5 Indiquer si la complexation des ions Cu2+ aq peut être modélisée par une loi d'ordre 1. Justifier.
La vitesse de consommation des ions Cu2+aq est proportionnelle à la concentration des ions Cu2+aq. Donc cinétique d'ordre 1.
|
|







