L'hydrogénation,
une voie de
valorisation possible pour le dioxyde de carbone.
Capture géologique du dioxyde de carbone.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Diminuer
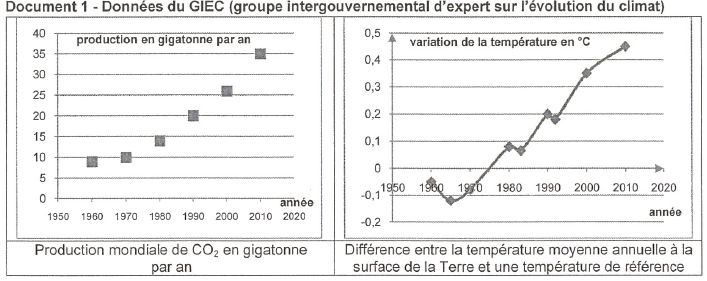
les émissions de gaz carbonique constitue l'un des défis majeurs du XXIè
siècle. Si aujourd'hui une faible quantité ( 0,5 %) des émissions de CO2
issu des activités humaines est valorisée au niveau mondial, certains
experts estiment que la valorisation du CO2 pourrait à terme
absorber annuellement jusqu'à 5 à 10 % des émissions mondiales.
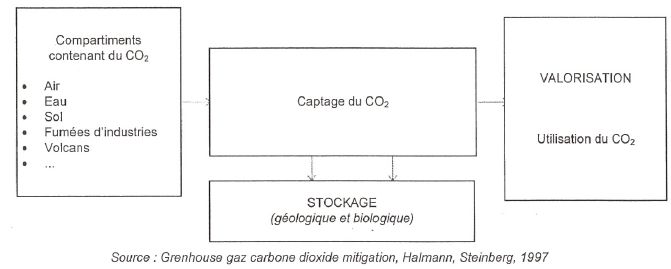
Traitement du dioxyde de carbone.
Document 3
: l'hydrogénation, une voie de valorisation du dioxyde de carbone.
Actuellement le CO2 est valorisé soit de manière directe,
par exemple en étant utilisé comme gaz réfrigérant, soit de manière
indirecte. Le CO2 est alors converti en un autre produit
industriel. L'hydrogénation du CO2
( réaction avec le dihydrogène et production d'eau dite réaction de
Sabatier ) est la voie de conversion la plus étudiée. Elle peut
conduire directement à la formation d'alcools, d'hydrocarbures... C'est
ainsi que les synthèse du méthanol, de l'éthanal CH3-CH sont
souvent envisagées, de même que la réaction qui mêne au méthane. Cette
dernière implique toutefois une plus large consommation de dihydrogène.
Document 4 : unité de
production de méthane au Japon.
L'un des grans groupes pétroliers - BP- et l'université
tchnologique de Tohoku développent, depuis 2003 une unité pilote
de production de méthane à partir du CO2 industriel et du
dihydrogène produit par électrolyse de l'eau de mer. Cette électrolyse
est alimentée par de l'énergie solaire.
l'unité consomme 4 m3/h de dihydrogène et 1 m3/h
de CO2 pour produire 1 m3/h
de méthane. A l'heure actuelle le méthane produit n'est pas utilisé
industriellement mais pourrait être utilisé comme combustible pour
produire de l'électricité ou comme carburant pour les véhicules.
La production d'électricité avec ce méthane serait préférable, elle
permettrait le recyclage des émissions de CO2 ; alors que
l'utilisation du méthane comme carburant pour véhicule n'autoriserait
pas ce recyclage car les émissions de CO2 sont diffuses.
D'après le rapport de l'ADEME - panorama sur les valorisations du CO2,
juin 2010.
Donnés énergétiques : énergie nécessaire pour :
- réaliser l'électrolyse de l'eau afin de fabriquer 1,0 m3
de dihydrogène : 20,0 MJ ;
- capturer et stocker 1,0 m3 de dioxyde de carbone
industriel : 8,0 MJ ;
- réaliser l'hydrogénation de 1,0 m3 de CO2
suivant la réaction de Sabatier : 7,0 MJ.
Energie récupérable par la combustion de 1,0 L de méthane : 33,0 kJ.
Proposer trois
pistes mises en oeuvre actuellement pour limiter l'émission de CO2
dans l'atmosphère.
Limitation de l'utilisation des combustibles fossiles et éviter la
déforestation.
Piègage du CO2 dans le sous-sol profond.
Valorisation du dioxyde de carbone industriel.
Faire le bilan
énergétique global de la production et de la combustion de 1 m3
de méthane obtenu par l'hydrogénation du CO2.
Bilan pour une heure de
production :
Fabrication de 4 m3 de dihydrogène : 80,0 MJ.
Capturer
et stocker 1,0 m3 de dioxyde de carbone industriel : 8,0 MJ.
Réaliser
l'hydrogénation de 1,0 m3 de CO2 suivant la
réaction de Sabatier : 7,0 MJ.
Total : 95 MJ dépensés.
Energie récupérée par la combustion de 1 m3 de méthane :
33,0 MJ.
Le bilan est négatif de : 95-33 =62 MJ.
Si l'électrolyse est alimentée à partir de l'énergie solaire :
Total : 15 MJ dépensés.
Energie récupérée par la combustion de 1 m3 de méthane :
33,0 MJ.
Le bilan est posittif de : 33-15 =18 MJ.
Mais la combustion du méthane produit du dioxyde de carbone.
Rédiger une synthèse
argumentée répondant à la problématique suivante :
Quels sont les enjeux environnementaux et l'interêt énergétique de la
valorisation du dioxyde de carbone ?
Le CO2 est un des gaz contribuant à
l'effet de serre. Le dioxyde de carbone joue un rôle majeur sur le
climat de la terre.
L'augmentation de la demande énergétique ne permet pas actuellement de
s'affranchir des énergies fossiles. L'effet des activités humaines sur
le réchauffement climatique général de la terre est étudié depuis une
vingtaine d'années. L'impact de l'émission de CO2 sur
l'acidification des milieux marins est beaucoup moins étudié. L'apport
massif de CO2 dans les océans entraine une diminution du pH
des eaux : les coraux blanchissent, la coquille des organismes
marins va devenir plus fine et plus fragile.
Les techniques visant à réduire les émissions de CO2
concernent les sources concentrées ( centrales thermiques,
sidérurgie, cimenteries). D'autres techniques visent à améliorer
l'efficacité énergétique des procédés.
La valorisation du dioxyde de carbone permet sa transformation et
rapporte de l'argent ; le stockage géologique n'élimine pas le CO2
et coûte cher.
Sans transformation le dioxyde de carbone est utilisé en tant que
solvant et réfrigérant.
En réagissant avec une autre espèce chimique, le dioxyde de carbone
conduit à un produit à valeur énergétique plus grande que le CO2.
Par la photosynthèse les algues conduisent à des produits de grand
intérêt.
|
...
|
....
|
Capture géologique du dioxyde de carbone. Procédé Carbfix.
Mise en évidence de l'acidité d'une solution de dioxyde de carbone.
Dans un becher de 100 mL contenant 50 mL d'eau distillée et quelques
gouttes d'indicateur coloré universel, une personne souffle dans l'eau,
à l'aide d'une paille, pendant quelques minutes.
La solution initialement verte ( pH ~7 ) devient jaune ( pH ~5,5).
1. Expliquer en quoi cette expérience met en évidence le caractère acide de la solution de dioxyde de carbone.
En soufflant dans la solution, la personne envoie du dioxyde de carbone dans l'eau.
L'indicateur coloré passe alorsdu vert au jaune ( de pH =7 à pH ~5,5). La solution devient acide.
Le dioxyde de carbone réagit avec l'eau selon :
CO2 aq +H2O(l) = H2CO3aq.
H2CO3 aq est susceptible de céder un proton H+aq pour conduire à HCO3-aq.
En conséquence H2CO3 aq est une base de Brônsted.
Le dioxyde de carbone, sous pression (25 bar et à la température
comprise entre 20 et 30°C) est dissout dans de l'eau puis injecté
dans des basaltes vers 500 m de profondeur. Les roches se dissolvent
partiellement libérant des ions Ca2+aq et Mg2+aq. Il se forme également des ions hydrogénocarbonate HCO3-aq et carbonate CO32-aq. Le dioxyde de carbone est alors piégé sous terre, sous forme de carbonate de calcium ou de magnésium.
Le débit massique d'eau liquide est 1800 g /s et le débit massique du dioxyde de carbone gazeux est de 70 g / s.
L'intégralité du dioxyde de carbone se dissout dans l'eau. On note S la solution obtenue.
2. Montrer que la concentration en quantité de matière d'acide carbonique H2CO3 aq est Cs = 0,88 mol / L.
A chaque seconde :
quantité de matière de dioxyde de carbone : 70 / M(CO2 = 1,59 mol.
Concentration en acide carbonique : 1,59 / volume solution = 1,59 / 1,8 =0,884 ~0,88 mol / L.
3. Calcul du pH initial de la solution S.
Compléter le tableau d'avancement suivant :
|
H2CO3aq
|
+H2O(l)
|
--> HCO3-aq
|
+H3O+aq
|
état initial
|
Cs
|
solvant
|
0
|
négligeable
|
A l'équilibre
|
Cs-xéq
|
solvant |
xéq |
xéq |
En déduire à l'équilibre, la relation entre la constante d'acidité pKa du couple (H2CO3aq / HCO3-aq), xéq, Cs et c°, concentration standard égale à 1,00 mol / L.
[HCO3-aq] = [H3O+aq] = xéq / c°.
[H2CO3aq] = (Cs-xéq) / c°.
Ka =[HCO3-aq] [H3O+aq] / [H2CO3aq].
Ka = xeq2 / ((Cs-xéq) c°)
xeq2 +Kac° xéq -Kac° Cs=0.
La résolution numérique de cette équation donne : xéq1 = 0,000591, seule valeur positive, donc retenue.
En déduire la composition S à l'équilibre, puis calculer son pH. Commenter.
[HCO3-aq] = [H3O+aq] =0,000591 mol / L.
pH = - log ( 0,000591)~3,2.
A pH << pKa, H2CO3aq prédomine.
[H2CO3aq] = 0,88 -0,000591 ~0,8794 ~0,88 mol / L.
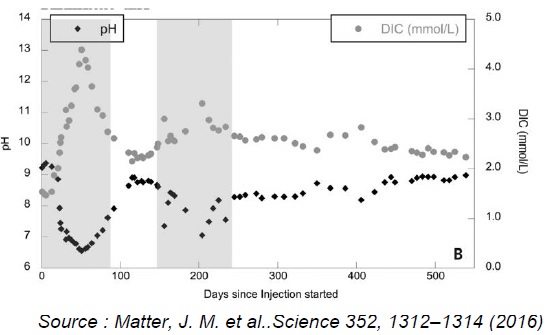
La DIC prend en compte l'ensemble des espèces carbonées inorganiques H2CO3aq, HCO3-aq, CO32-aq.
Expliquer l'évolution des courbes ci-dessus.
A chaque injection de dioxyde de carbone, le pH diminue ( H2CO3 est un acide) et la DIC croît rapidement.
Puis H2CO3 aq réagit avec les roches basaltiques. Il se forme des ions hydrogénocarbonate HCO3-aq et carbonate CO32-aq puis CaCO3(s) et MgCO3(s) : le pH de la solution augmente, tandis que la DIC diminue.
|
|


