Du
soleil en bouteille, bac S Nlle Calédonie 12 / 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Une
partie de l'énergie électrique produite par les panneaux
photovoltaïques alimente un électrolyseur contenant de l'eau, l'autre
partie de cette énergie sert à alimenter le réseau électrique local.
l'électrolyse de l'eau produit du dihydrogène et du dioxygène stockés
dans des citernes. La nuit ou lors d'un pic de consommation, une pile à
combustible utilise ces deux gaz pour produire de l'énergie électrique.
Questions préliminaires.
1. Montrer que l'énergie électrique reçue quotidiennement par l'électrolyseur est d'environ Eélectrolyseur = 2,0 GJ.
Surface des panneaux : S = 3700 m2.
Energie solaire moyenne reçue quotidiennement par m2 de panneau photovolyaïque :15 MJ.
Rendement des panneaux : 12 %.
Energie électrique moyenne produite par jour : 3700 x15 x0,12 =6 660 MJ = 6,66 GJ.
L'électrolyseur reçoit 30 % de cette énergie : Eélectrolyseur = 6,66 x0,30 ~ 2,0 GJ.
2.
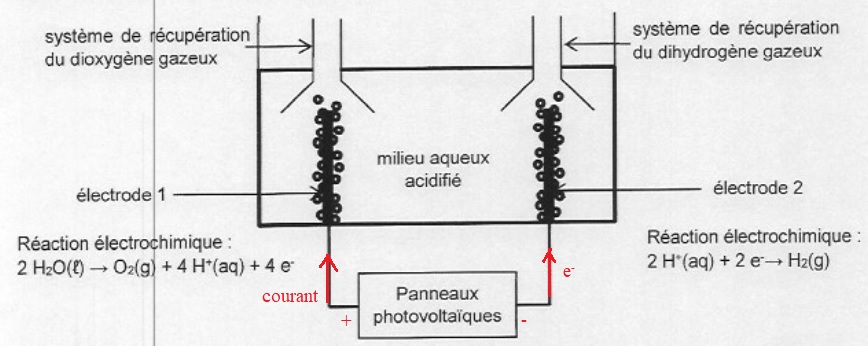
Etablir le sens de circulation des électrons et du courant entre le
panneau photovoltaïque et la cellule d'électrolyse lors de son
fonctionnement. En déduire l'électrode qui est reliée à la borne
positive du panneau.
L'électrode 1 est une anode positive : oxydation de l'eau et libération d'électrons.
L'électrode 2 est une cathode négative : réduction des ions H+aq.
Problème.
Le dihydrogène produit par l'électrolyse, est stockée dans une citerne
sous haute pression. On peut y stocker l'équivalent d'un volume de 1400
m3 de dihydrogène à 20°C sous une pression P = 1,013 105 Pa.
Estimer la durée nécessaire pour remplir complétemant une citerne, initialement vide, avec du dihydrogène.
Quantité de matière de dihydrogène stockée :
n = PV / (RT) avec T = 273+20 = 293 K
n =1,013 105 x1400 /(8,314 x293)=5,82 104 mol.
ou bien 1400 / Vm = 1400 / 0,024 = 5,82 104 mol.
Quantité de matière d'électrons : 2H+aq +2e- = H2(g).
2n =1,164 105 mol.
Charge électrique correspondante : Q=1,164 105 x 96 500 =1,12 1010 C.
Tension aux bornes de l'électrolyseur U =2,0 V.
Energie électrique nécessaire : QU =1,12 1010 x 2,0 =2,24 1010 J =22,4 GJ.
Durée de l'électrolyse : 22,4 / 2,0 = 11,4 jours.
|