Vers
la synthèse du plexiglas, bac Métropole 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Etude de l'acide métacrylique.
1.1. Indiquer les précautions opératoires et les équipements de sécurité nécessaiires à la manipulation de cet acide.
Nocif en cas d'ingestion et d'inhalation ; provoque des brûlures.
1.2 Représenter la formule topologique de cet acide en entourant et nomant les groupes caractéristiques.
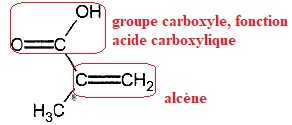
1.3 Justifier que la molécule d'acide méthacrylique est un acide et écrire le couple acide / base associé.
Cette molécule est susceptible de libérer un proton, c'est donc un acide.
C4H6O2 / C4H5O2-.
1.4 Ecrire l'équation de la réaction de cet acide, noté AH dans l'eau.
AH aq + H2O(l) ---> A-aq +H3O+aq.
1.5 Donner la relation entre la constnte d'acidité Ka de ce couple et les concentrations à l'équilibre des espèces.
Ka = [H3O+][A- ] / [AH]
1.6 Vérifier que le pH d'une solution aqueuse d'acide méthacrylique de concentration 100 g / L est 2,3.
M(acide méthacrylique)=88,1 g / mol.
C =100 / 88,1 =1,135 mol / L ; pKa = 4,7. ( Ka = 2 10-5).
[H3O+] = [A- ], solution électriquement neutre.
[AH] = C-[A- ], conservation de A.
Ka = [H3O+]2 / (C-[H3O+]).
On pose x = [H3O+].
(1,135-x)2 10-5 = x2.
x2+ 2 10-5x-1,27 10-5 =0.
Discriminant D =4 10-10+5,08 10-5 ~5,08 10-5= (7,13 10-3)2.
Solution positive retenue : (2 10-5 +7,13 10-3 ) / 2 ~3,57 10-3.
pH = - log(3,57 10-3) ~2,4.
2. Synthèse du monomère : le méthacrylate de méthyle (MMA).
Etape a.
Dans un ballon de 100 mL, placer 10,0 g d'acide méthacrylique. Ajouter
35 mL de méthanol et 2 gouttes d'acide sulfurique concentré. Adapter un
réfrigérant et porter à reflux durant 30 minutes.
Etape b
: refroidir le milieu réactionnel puis le verser dans 50 mL d'eau
glacée. Procéder à deux extraction liquid-liquide avec 25 mL d'éther
ethylique. Rassembler les phases organiques, les laver avec
successivement 30 mL d'eau glacée, 50 mL d'une solution
d'hydrogénocarbonate de sodium, puis 30 mL d'une solution saturée de
chlorure de sodium. Sécher la phase organique sur sulfate de magnésium
anhydre.
Etape c.
Mettre en place un montage de distillation fractionnée. Récupérer la
fraction distillée correspondant au MMA et mesurer la masse du liquide
obtenu.
2.1. Réaliser un schéma légendé du montage à reflux et proposer un nom pour cette étape.
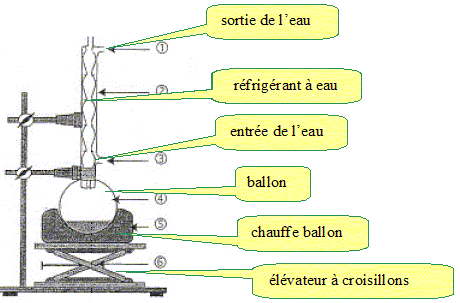
Synthèse du MMA.
2.2. Etablir l'équation de la réaction modélisant la synthèse.
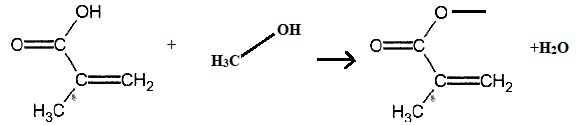
2.3 Justifier
les positions des phases organique et aqueuse lors du lavage à l'eau
glacée dans l'ampoule à décanter ( étape b). Donner la composition de
chaque phase.
La phase aqueuse la plus dense occupe la partie inférieure. ( eau,
acide métyhacrylique et méthanol n'ayant pas réagi, acide sulfurique ).
Phase organique ( éther diéthylique, métacrylate de méthyle).
2.4 Donner le rôle de l'étape c et indiquer ce qui doit être survaille pour être sûr de récupérer le MMA.
Purification
par distillation fractionnée , on élimine le solvant l'éther qui
distille vers 35°C : surveiller la température et récupérer le MMA qui
distille vers 101 °C.
2.5. Déterminer les quantités de matière des réactifs introduits.
n(acide méthacrylique) = 10,0 / M(acide méthacrylique)=10,0 / 86,1 =0,116 mol.
m(méthanol)= volume (mL) x densité = 35 x0,79 =27,65 g.
n(méthanol)= 27,65 / M(méthanol) = 27,65 / 32 =0,864 mol ( grand excès).
2.6. Déterminer la masse maximale de MMA pouvant être obtenu.
n(MMA) = 0,116 mol
M(MMA) =100,1 g / mol.
Masse maximale : 0,116 x100,1 ~11,6 g.
2.7. Indiquer
une méthode mise en oeuvre pour optimiser la vitesse d'apparition du
MMA et une méthode mise en oeuvre pour optimiser le rendement.
En utilisant un catalyseur ( acide sulfurique) on atteint plus rapidement l'équilibre sans modifier sa composition.
Pour optimiser le rendement, on ajoute en excès le méthanol ou on élimine l'eau au fur et à mesure de sa formation.
|
...
|
....
|
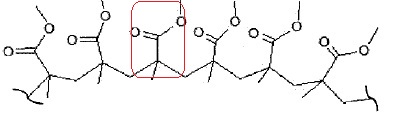
Synthèse et propriétés du polymère ( PMMA).
Le PMMA est une macromolécule linéaire.
3.1. Entourer le motif du polymère.
3.2. Justifier que l'on puisse suivre la transformation par spectroscopie IR.
Le spectre IR du MMA possède une bande fine vers 1650 cm-1, liaison C=C.
Cette bande disparaît du spectre IR du PMMA.
3.3. Déterminer le temps de demi-réaction t½ de la polymérisation du MMA.
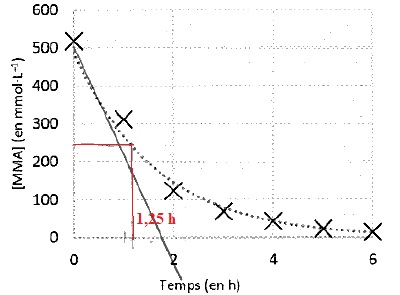
Cette réaction est assez rapide.
3.4. Déterminer la vitesse vP initiale de disparition du MMA.
Valeur absolue de la tangente à l'origine :
500 / 1,75 ~286 mmol L-1 heure-1.
3.5. Déterminer si l'évolution temporelle de la concentration en MMA suit une loi de vitesse d'ordre 1.
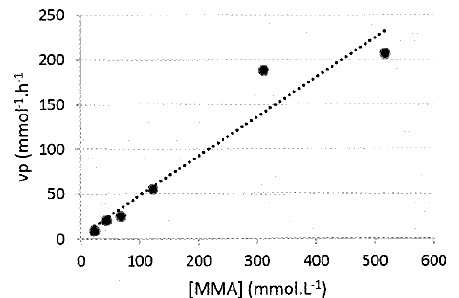
D'après ce graphique, vP = k [MMA], fonction linéaire de la concentration en MMA.
L'évolution temporelle de la concentration en MMA suit une loi de vitesse d'ordre 1.
|
|