Synthèse
de Cannizzaro, bac Métropole 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
A partir du benzaldehyde, ce chimiste obtient l'alcool benzylique puis l'ion benzoate.
Modélisation de cette synthèse.
Elle
peut être modélisée par une réaction d'oxydo-réduction dans laquelle un
même réactif, le benzaldéhyde, est à la fois l'oxydant et le réducteur.
On parle de dismutation.
2 C6H5CHO (l) + HO-aq --> C6H5COO- aq + C6H5CH2-OH (l).
1.1 Recopier la formule du benzaldehyde, entourer le groupe caractéristique et nommer la famille fonctionnelle correspondante.
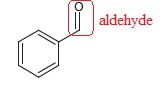
1.2. Justifier qu'il s'agit d'une dismutation.
Oxydation du benzaldehyde , le réducteur :
C6H5CHO (l) + 3HO-aq --> C6H5COO- aq + 2e- +2 H2O(l).
Réduction du benzaldehyde,l'oxydant :
C6H5CHO (l) + 3HO-aq --> C6H5COO- aq + 2e- +2 H2O(l).
C6H5CHO (l) + 2e- + 2H2O(l) --> C6H5CH2-OH (l) +2HO-aq.
2 Optimisation de la synthèse.
On mélange dans un ballon une solution d'hydroxyde de potassium et du
benzaldehyde commercial, puis on agite vigoureusement. On travaille
avec une solution concentrée d'hydroxyde de potassium et un montage à
reflux.
Justifier ces choix.
Les concentrations des réactifs sont un facteur cinétique.
La température est également un facteur cinétique : le chauffage à
reflux permet de travailler à température modérée tout en évitant les
pertes de matière. Les vapeurs se condensent dans le réfrigérant et
retombent dans le milieu réactionnel.
3. Séparation et contrôle de la pureté des produits.
En
fin de réaction, on verse le contenu du ballon dans une ampoule à
décanter et on réalise une extraction liquide-liquide en utilisant
l'éther éthylique comme solvant extracteur. Après décantation, on
distingue une phase aqueuse et une phase organique non miscibles que
l'on sépare.
La phase organique est évaporée et on récupère un produit A sous forme liquide.
La phase aqueuse est placée dans un grand becher placé dans un bain de
glace. On y verse goutte à goutte une solution concentrée d'acide
chlorhydrique jusqu'à ce que le pH soit égal à 2. Un solide B se forme.
On réalise une chromatographie sur couche mince des produits A et B.
Tous les produits sont dissous à 1 % dans le dichlorométhane.

|
...
|
....
|
3.1.
Effectuer un schéma légendé de l'ampoule à décanter en précisant les
phases présentes et leurs compositions respectives après décantation.
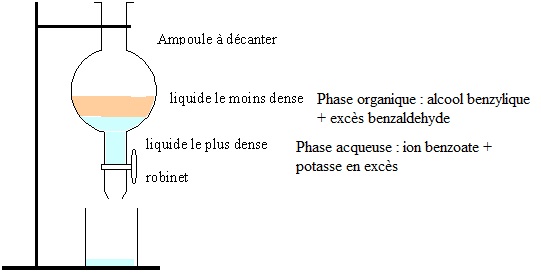
3.2. Justifier le choix de l'éther éthylique.
L'eau et l'éther ne sont pas miscibles.
Le produit A, alcool benzylique, est très soluble dans l'ether et très peu soluble dans l'eau.
Le produit B, ion benzoate, est très soluble dans l'eau et insoluble dans l'éther.
3.3. Justifier que l'on veuille obtenir un pH inférieur à 2 pour la phase aqueuse.
pKa( acide benzoïque / ion benzoate = 4,2.
A pH < 2, l'acide benzoïque prédomine et celui-ci est insoluble dans l'eau.
3.4. Donner l'intérêt du bain de glace et d'eau.
La température de ce bain est égale à 0°C. La solubilité de l'acide benzoïque est très faible à °C.
3.5. Citer une technique permettant d'isoler le produit B de la phase aqueuse.
Filtration sur büchner.
3.6. En utilisant le chromatogramme, conclure sur l'efficacité de l'étape de séparation des produits.
3.7. En utilisant le chromatogramme, conclure sur la pureté des produits.
Le produit A n'est pas pur : il contient du benzaldehyde et de l'alcool benzylique.
Le produit B est pur, on l'identifie à l'acide benzoïque.
|
|