De
la citronelle des Indes à l'époxycitral, bac S Métropole 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
1. Obtention du citral à partir des feuilles de citronelle des Indes.
L'huile essentielle de citronnell des Indes est obtenue par
hydrodistillation des feuilles de cette plante. On récupère un
mélange hétérogène d'eau et d'huile essentielle de citronnelle. Cette
huile est concidérée comme un mélange homogène de citral et de myrcène.
Les deux phases de ce mélange hétérogène sont versée dans una ampoule à décanter.
1.1. Schématiser l'ampoule à dcanter et indiquer en justifiant les deux phases présentes et leur composition.
Les masse volumiques du citral ( 0,89 g / mL) et du myrcène ( 0,79 g /
mL) étant inférieures à celle de l'eau, l'eau occupe la partie
inférieure de l'ampoule à décanter.
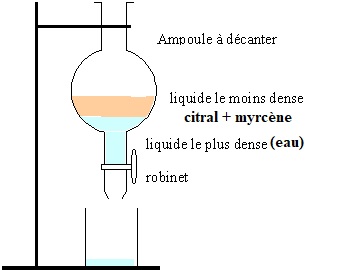
On recueille l'huile essentielle et on réalise une distillation
fractionnée de cette phase organique recueillie, ce qui permet de
séparer le citral du myrcène.
1.2 Nommer les éléments du montage numérotés de 1 à 4.
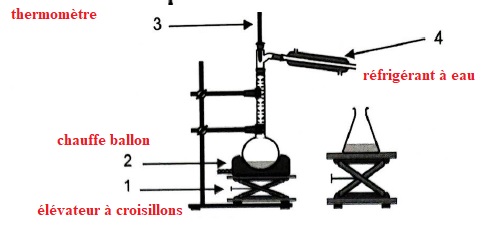
1.3. Expliquer le rôle des éléments 1 à 4 du montage.
1. L'élévateur à croisillons ( support élévateur )permet de monter ou descendre le chauffe ballon.
2. Le chauffe ballon permet de régler l'intensité du chauffage en évitant toute flamme.
3. Le thermomètre donne la température des vapeurs et donc d'identifier l'espèce chimique.
4. Dans le réfrigérant à eau les vapeurs se condensent.
1.4 Identifier , en justifiant, l'espèce chimique recueillie en premier.
L'espèce la plus volatile, température d'ébullition la plus faible, distille en premier : le myrcène.
|
...
|
....
|
2. Synthèse de lépoxycitral.
Le protocole simplifié de la synthèse de l'époxycitral est décrit ci-dessous :
Placer un erlenmeyer dans un bain d'eau glacée. Ajouter successivement :
Vc = 1,0 mL de citral.
Vh = 2,0 mL de solution aqueuse de peroxyde d'hydrogène, de concentration c = 9,8 mol / L.
7 mL de méthanol, solvant.
Une solution aqueuse concentrée d'hydroxyde de sodium ajoutée en excès.
Agiter pendant 10 minutes.
Ajouter 5 mL d'eau distillée et 15 mL d'éther éthylique pour extraire le produit formé.
Séparer les phases organique et aqueuse à l'aide d'une ampoule à décanter.
Sécher la phase organique, puis évaporer le solvant sous la hotte.
Réaliser le spectre RMN du produit formé.
L'équation de la réaction de synthèse est la suivante :

2.1. Indiquer
pourquoi il est nécessaire que le milieu réactionnel soit très basique,
avec un pH proche de 14, pour réaliser cette synthèse.
Couple acide / base H2O2(aq) / HO2-(aq) : pKa = 11,7 à 20 °C.
HO2-(aq), l'un des réactif, est largement majoritaire à pH supérieur à 13.
Le spectre RMN du proton du produit obtenu est donné ci-après.
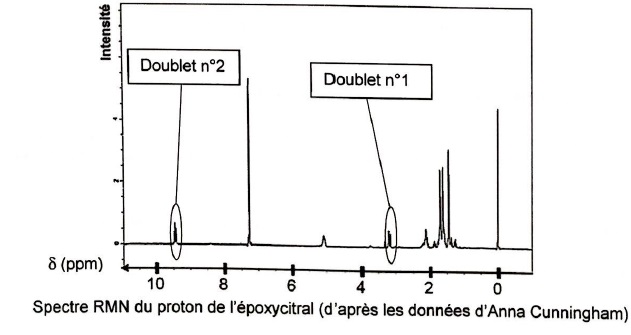
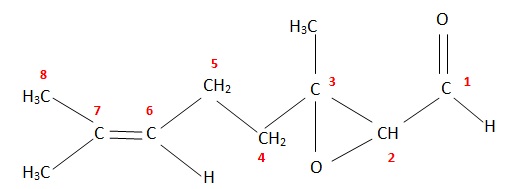
2.2. Représenter la formule semi-développée de l'époxycitral.
2.3. Attribuer en
justifiant avec deux arguments, les doublets n°1 et n°2 du spectre RMN
aux groupes de protons équivalents de cette molécule.
Doublet n°1 : hydrogène porté par le carbone n°2.
Les carbones voisins portent un seul atome d'hydrogène, donc le signal est un doublet.
Le déplacement chimique de ce type de proton ( carbone lié à un oxygène) est compris entre 3 et 3,5.
Doublet n°2 : hydrogène porté par le carbone n°1.
Le carbone voisin porte un seul atome d'hydrogène, donc le signal est un doublet.
Le déplacement chimique de ce type de proton ( fonction aldehyde) est compris entre 9 et 10.
On obtient après séchage et évaporation du solvant une masse m = 0,95 g d'époxycitral ( M = 168 g / mol)
2.4. Déterminer la valeur du rendement de cette synthèse.
Citral , réactif limitant : V = 1,0 mL; masse volumique : 0,89 g / mL.
masse : 1,0 * 0,89 = 0,89 g.
M(citral) = 152 g / mol.
n = 0,89 / 152 = 5,86 10-3 mol.
Quantité de matière théorique d'époxycitral : 5,86 10-3 mol.
Masse théorique : 5,86 10-3 x 168 =0,98 g.
Rendement : masse réelle / masse théorique = 0,95 / 0,98 ~0,97 ( 97 %).
|
|