Un
ester utilisé en parfumerie, bac S Antilles 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
...
|
....
|
2. Synthèse du valérate d’éthyle
La synthèse du valérate d’éthyle a été réalisée. Un compte rendu a été
rédigé dans le cahier de laboratoire dont un extrait figure ci-après :
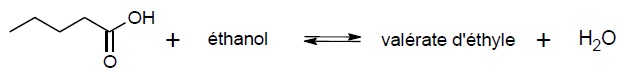
Équation chimique de la synthèse :
Protocole de la synthèse de l’ester à odeur fruitée :
- dans un ballon, introduire un mélange équimolaire d’acide valérique
et d’éthanol. Ajouter 15 gouttes d’acide sulfurique concentré ;
- chauffer à reflux ce mélange pendant 30 minutes ;
- laisser refroidir, puis introduire le contenu du ballon dans une ampoule à décanter contenant 200 mL d’eau salée froide ;
- agiter et laisser décanter quelques heures ;
- récupérer la phase organique contenant l’ester dans une éprouvette graduée.
Résultats expérimentaux :
Volume d'ester obtenu : 22 mL ; masse d'ester 19,36 g. Rendement 87 %.
Masse volumique de l'eau salée : 1,1 g / mL.
2.1 Compléter l'équation chimique de la synthèse avec les formules topologiques manquantes.
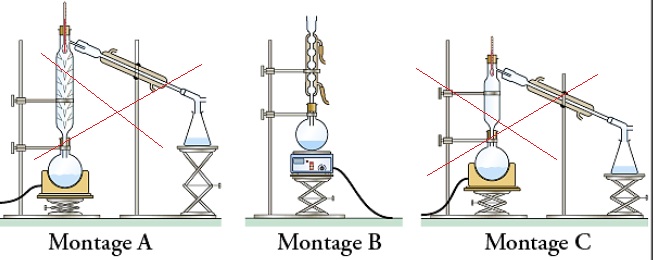
2.2. Expliquer le rôle du chauffage à reflux puis identifier parmi les montages suivants celui utilisé pour réaliser la synthèse.
La
température est un facteur cinétique ; en chauffant on accélère la
réaction sans perte de matière. Les vaoeurs se condensent dans le
réfrigérant et retombent dans le milieu réactionnel.
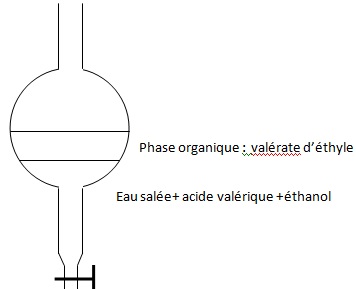
2.3 Schématiser et légender l'ampoule à décanter à la fin de la décantation. Identifier les positions relatives des deux phases.
La phase la plus dense ( eau salée) occupe la partie inférieure.
2.4 Déterminer la quantité de matière d'ester qui aurait dû se former si la réaction avait été totale.
Rendement = masse expérimentale / masse théorique.
Masse théorique d'ester : 19,36 / 0,87 =22,25 g.
M(ester) = 130 g / mol.
Quantité de matière thèorique d'ester :n = 22,25 / 130 ~0,17 mol.
2.5 Montrer que le volume d'éthanol est V= 10 mL et déterminer la masse d'acide valérique utilisé.
n(éthanol) = 0,17 mol ; M (éthanol) = 46 g / mol. Masse d'éthanol : 46 x0,17 =7,87 g.
Msse volumique éthanol : 0,789 g / mL. Volume éthanol : 7,87 / 0,789 ~10 mL.
n( acide valérique) = 0,17 mol ; M( acide valérique) =102 g/mol.
Masse d'acide valérique = 102 x0,17 =17,34 ~17 g.
2.6 Comment peut-on vérifier que le produit obtenu est le valérate d'éthyle ?
Réaliser le spectre RMN du proton, le spectre infrarouge du produit.
|
|