Analyse
de l'alcool dans l'air expiré : éthylotest / éthylomètre.
Concours technicien principal de police technique et scientifique 2019
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
L'éthylotest de type A, à usage unique est constitué :
- d'un ballon de matière plastique de volume 1 L muni d'un embout
- d'un tube de verre rempli d'un gel de silice imprégné d'une solution acide de dichromate de potassium ( K2Cr2O7 ).
Le conducteur gonfle totalement le ballon en soufflant dedans puis
adapte celui-ci sur le tube en verre et vide totalement le ballon en
faisant passer l'air à travers le tube.
Si l'air expiré contient de l'éthanol, celui-ci réagit avec les ions
dichromate ( couleur orange ) qui sont réduits en ion chrome (III) (
couleur verte).
Trois minutes après avoir soufflé, on mesure la longueur du changement
de couleur dans le tube actif, sensiblement proportionnelle à la
concentration d'éthanol expiré. Un repère indique le dépassement du
seuil de 0,25 g / L d'air expiré.
1. Déterminer le nombre d'oxydation noté no de l'élément chrome dans Cr2O72- et Cr3+.
Cr2O72- : 2 no +7 (-2) = -2 ; no = +VI ; Cr3+ : no = III.
2. L'équation de la réaction :
2.1 Ecrire les demi-équations électroniques de chacun des deux couples qui interviennent dans le fonctionnement de l'ethylotest.
2.2 En déduire l'équation bilan de la réaction chimique.
3 fois{ C 2 H 6
O +H 2O= C 2H 4 O 2 + 4 électrons + 4H +}.
2 fois{Cr 2O 72- + 6 electrons +14 H +
= 2 Cr 3+ + 7 H 2O }.
3 C 2 H 6 O + 2Cr 2O 72-
+28 H + +3H 2O---> 3 C 2H 4 O 2 + 4 Cr 3+
+ 12 H + + 14 H 2O.
3 C 2 H 6 O + 2Cr 2O 72-
+16 H + ---> 3 C 2H 4 O 2 + 4 Cr 3+ + 11 H 2O.
3.La réaction de l'ion dichromate sur l'éthanol est quantitative.
3.1. Déterminer le nombre de mole d'éthanol maximal autorisé, expiré par litre d'air.
M(C2H6O) = 46 g / mol ; 0,25 / 46 = 5,435 10-3 mol ~5,4 mmol.
3.2. En déduire la masse de dichromate de potassium nécessaire pour faire réagir cette quantité d'alcool.
M(K2Cr2O7 ) = 2 x40 +2 x52 +7 x16)=294 g / mol.
n(alcool) =1,5 n(Cr2O72-).
n(Cr2O72-) = 5,435 / 1,5 =3,62 mmol.
Masse : 3,62 x 294 = 1065 mg ~1,1 g.
4.
Ces dispositifs à usage unique donnet des faux positifs avec d'autres
alcolls ( méthanol, propan-1-ol ) mais également avec les aldéhydes
contenus parfois en grande quantité dans les boissons obtenues à partir
des fruits pressés. Qu'est-ce qu'un faux positif ?
Le test n'étant pas spécifique à l'éthanol, un résultat déclaré positif peut être en réalité négatif.
5. La fiche de sécurité du dichromate de potassium comporte plusieurs pictogrammes. Quelle est la signification de chacun d'eux ?

1 : comburant ; 2 : corrosif ; 3 : toxique ; 4 : cancérigène ; 5 : danger pour l'environnement.
.
|
|
|
L'éthylotest électronique est basé sur le principe d'une pile.
L'automobiliste souffle dans ce dispositif à l'aide d'un embout bucal à
usage unique, jusqu'à ce qu'un signal sonore qui correspond à un volume
d'air déterminé. Grâce à un catalyseur, l'éthanol est oxydé en éthanal.
Cette réaction génère des électrons dont la circulation génère un
courant électrique proportionnel à la concentration d'éthanol. Au bout
de 20 s, le résultat s'affiche.
On donne le schéma de la pile constituée de deux compartiments séparés
par une membrane électrolytique qui permet le passage des protons.
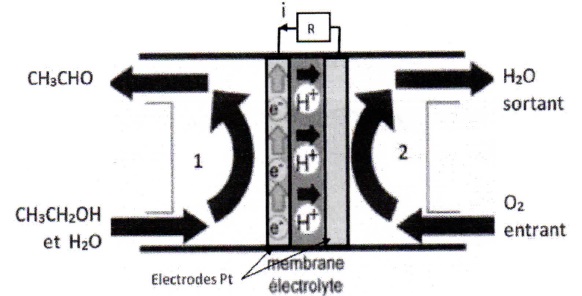
6. Quelle demi-pile constitue l'anode ? Justifier.
A l'anode on observe l'oxydation de l'éthanol. Celle-ci libère des électrons. L'anode est négative. ( électrode de gauche).
7. Demi-pile 1 :
Ecrire la demi-équation électronique correspondante.
C2H6O = C2H4O + 2H+ 2e-.
Donner l'expression litérale du potentiel de Nernst.
E1 = E°(C2H4O / C2H6O ) +0,03 log ([C2H4O] [H+]2 / [C2H6O] )
8. Demi-pile 2 :
Ecrire la demi-équation électronique correspondante.
½O2(g) + 2H+ 2e-= H2O..
Donner l'expression litérale du potentiel de Nernst.
E2 = E°(O2 / H2O ) +0,03 log (P(O2) ).
9. Ecrire l'équation de la réaction de fonctionnement de la pile.
C2H6O +½O2(g)= C2H4O + H2O.
10. Donner l'expression littérale de la constante K associée à cette réaction.
K = [C2H4O] / ( [C2H6O] P(O2)).
11. Calculer K et conclure.
E2 -E1 =E°(O2 / H2O ) - E°(C2H4O / C2H6O ) + 0,03 log ( [C2H4O] /(P(O2) [C2H6O] )).
A l'équilibre E2 =E1 ; E°(O2 / H2O ) - E°(C2H4O / C2H6O ) = 0,03 log (K).
1,23-0,19 = 1,04 = 0,03 log (K) ; log K = 1,04 / 0,03 ~35. k ~1035.
K étant très grand, la réaction est totale.
|
|
...
...
|
|
Ethylomètre à capteur à détection par infrarouge.
Ils mesurent la concentration en éthanol par analyse de l'air expiré.
Leur fonctionnement repose sur l'absorption das alcools dans
l'infrarouge.
La mesure s'effectue à l1 = 3,39 µm et à l2 = 3,48 µm. Une seconde mesure est réalisée à l3 = 9,4 µm. C'est une méthode sélective à la molécule d'éthanol.
12. Sur le spectre IR ci-dessous, à quelle grandeur correspond l'axe des abscisses ? L'axe des ordonnées ? Préciser les unités.
Nombre d'onde, inverse d'une longueur d'onde ( cm-1) en abscisse.
Transmittance, sans unité ( en pourcentage ) axe des ordonnées.
13. A quelle bande correspondent chacune des longueurs d'onde.
3,4 µm = 3,4 10-4 cm ; nombre d'onde : 1/(3,4 10-4) =2940 cm-1 ( vibration élongation C-H).
9,4 µm = 9,4 10-4 cm ; nombre d'onde : 1/(9,4 10-4) =1050 cm-1 ( vibration élongation C-O).
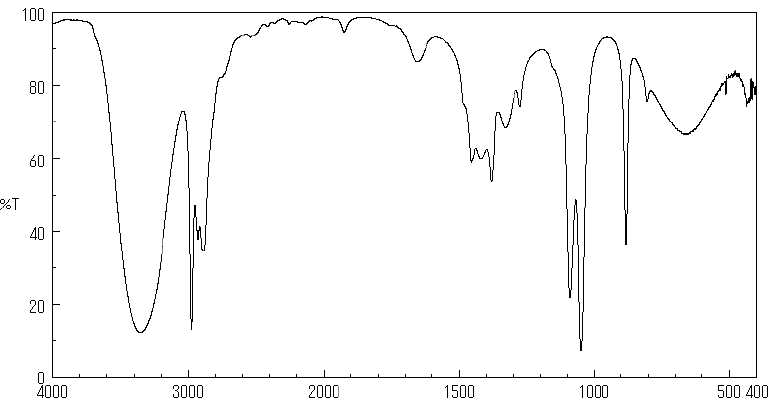
14. A quelle vibration correspond la bande large et forte à 3360 cm-1 ? A quelle vibration correspond-t-elle ?
Pourquoi ne pas utiliser cette bande pour déterminer la teneur en éthanol de l'air expiré ?
Vibration
O-H lié : bande large et forte due aux liaisons hydrogène multiples
entre molécules d'éthanol. La surface de cette bande dépend du nombre
de liaisons hydrogène, très variable.
15. Quelle est la loi qui relie la grandeur mesurée à la concentration ?
Loi de Beer-Lambert.
|
|
|


