Coupe
du monde et dopage, concours général 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
L’EPO
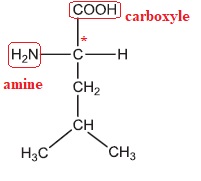
est principalement formée d’une chaîne d’acides aminés, parmi lesquels
la L-leucine, dont la représentation de Fischer est donnée ci-dessous :
1. Identifier et nommer les groupes fonctionnels présents dans cette molécule.
2. Identifier le(s) atome(s) de carbone asymétrique(s) de la L-leucine.
En réalité, la L-leucine n’existe pas en solution aqueuse sous la forme représentée cidessus.
En effet, en fonction de la valeur de pH du milieu dans lequel elle se
trouve, les trois formes acido-basiques possibles sont les suivantes.
Les deux valeurs de pKa associées à la L-leucine sont 2,4 et 9,6. On donne de plus les pKa des couples acide éthanoïque/ion éthanoate et ion ammonium/ammoniac :
pKa(CH3COOH/CH3COO–) = 4,8 ; pKa(NH4+/NH3) = 9,2.
3. Attribuer les deux pKa de la L-leucine aux couples correspondants.
4. Compléter le diagramme de prédominance des formes acido-basiques de la L-leucine ci-dessous.
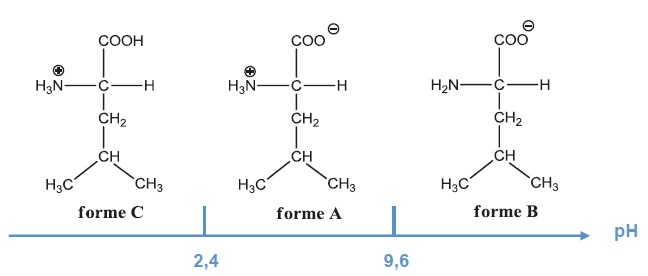
5. Donner la valeur du point isoélectrique de la L-leucine.
pI =0,5 (pKa1 + pKa2) =0,5(2,4 +9,6) =6.
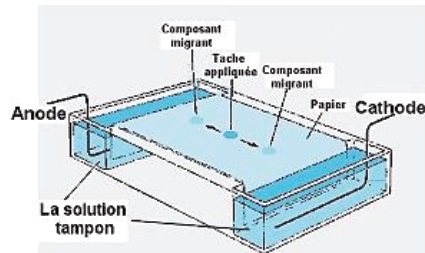
Les différents acides aminés d’un mélange peuvent être séparés par électrophorèse.
Elle consiste en la séparation des ions d’un mélange en fonction de leur charge et de leur taille, sous l’effet d’une différence
de potentiel électrique appliquée entre deux électrodes. Le plus
couramment, l’échantillon est déposé sur un support (par exemple une
bande de papier ou d’acétate de cellulose) imbibé d’une solution de pH
fixé, appelée solution tampon.
La focalisation isoélectrique (FIE) est un type d’électrophorèse
permettant de séparer un mélange de molécules en fonction de la valeur
de leur point isoélectrique.
Le principe de base de la focalisation isoélectrique est de créer une
zone de variation de pH dans laquelle peuvent se déplacer les protéines
soumises à un champ électrique. Les protéines migrent dans ce champ
électrique. Arrivées au pH correspondant à leur pI, elles
s'immobilisent. De cette façon, il est possible de séparer les
protéines d'une préparation selon leur pI.
https://commons.wikimedia.org/wiki/File:Montage_focalisation_iso%C3%A9lectrique.jpg.
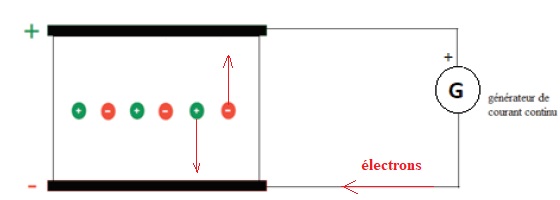
6. Dans le schéma
simplifié d’une électrophorèse ci-dessus, préciser quel pôle correspond
à l’anode et quel pôle correspond à la cathode.
Quand le pH augmente, un acide aminé se trouve sous forme anionique. Il se déplace donc vers l'électrode positive. (anode).
7. Compléter la
figure en y ajoutant des flèches indiquant le sens de déplacement des
électrons dans les fils, ainsi que le sens de déplacement des ions sur
le support.
Ainsi, le pI de l’EPO endogène est compris dans une zone de pH s’étendant environ de 3,7 à 4,7, tandis que celui de l’EPO recombinante est compris dans l’intervalle de pH 4,4-5,1.
8. Pour pH < pI, quel est le signe de la charge globale du composé ? Même question pour pH > pI.
Pour pH < pI, la forme cationique prédomine.
Pour pH > pI, la forme anionique prédomine.
9. Expliquer ces phrases « Les protéines migrent dans ce champ électrique. Arrivées au pH correspondant à leur pI, elles s'immobilisent. »
A pH = pI, la charge globale de la protéine est nulle. Une espèce neutre, n'est pas soumis à une force électrique.
10. En déduire quel doit être le sens de variation du pH dans la figure. Voir ci-dessus.
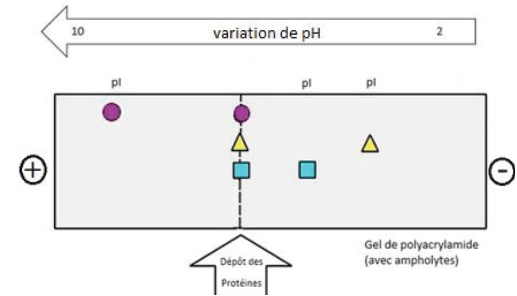
Trois exemples de résultats d’analyse par FIE sont présentés ci-dessous.

https://precisionbiosystems.com/western-blot-application-note/
11. Attribuer à chaque bande l’un des choix suivants :
L'EPO endogène s'immobilise dans la zone de pH comprise entre 3,7 et 4,7.
L'EPO recombinante ( dopage) s'immobilise dans la zone de pH comprise entre 4,4 et 5,1.
2 : échantillon contrôlé négatif à l’EPO recombinante (mais contenant aussi de l’EPO endogène) ;
3 : échantillon contrôlé positif à l’EPO recombinante (contenant peu ou pas d’EPO endogène) ;
1 : échantillon suspect susceptible de contenir de l’EPO recombinante en plus de l’EPO endogène.
|
|
|
..
L’EPO n’est pas le seul produit dopant chez les sportifs, une étude sur
le dopage conduite par l’UEFA, l’instance européenne du football, a
révélé un nombre inattendu de taux élevés de testostérone suggérant que celle-ci s’est aussi introduite dans le monde du football en tant que produit dopant.
12. Que signifie le terme « lipophile » ?
Ami des graisses.
13. Expliquer la
phrase suivante du document 5 : « Ces dérivés estérifiés lipophiles
sont injectés sous forme de solutions huileuses et sont libérés dans la
circulation sanguine d'autant plus lentement que la chaîne carbonée est
longue ».
Une longue chaine carbonée est lipophile : en conséquence le passage dans le sang de ce type de composé est lent.
De même que l’EPO, la testostérone existe sous forme endogène
(c’est-à-dire produite naturellement par le corps) et exogène
(synthétique). Le dépistage de testostérone exogène dans les urines se
fait par un appareil constitué d’un chromatographe en phase
gazeuse (GC) couplé à un spectromètre de masse de rapport isotopique (IRMS) via une interface de combustion (C).
Après séparation de la testostérone et de ses différents métabolites, les molécules subissent une combustion produisant CO2 et H2O. Après élimination de l’eau, le dioxyde de carbone est injecté dans le spectromètre de masse, dans lequel il est ionisé en CO2
+. L’appareil sépare les ions issus des deux
isotopes en fonction de leur rapport masse/charge (m/z). Le principe de
l’analyse repose sur le fait que la teneur en isotope 13 du carbone
(13C) est différente suivant l’origine endogène ou exogène des
métabolites de la
testostérone, la testostérone exogène contenant moins de 13C que son homologue endogène. L’appareil mesure alors le rapport isotopique 13C /12C et fournit la déviation isotopique d13C, exprimée en ‰ et définie par :
d13C =(13C /12C échantillon - 13C /12Créférence) / 13C /12Créférence) x1000.
Les déviations isotopiques ont des valeurs négatives. La référence utilisée est le VPDB (Vienna Pee Dee Belemnite) pour lequel 13C/12C
= 0,0112372. On peut conclure à une administration exogène de
testostérone lorsque la différence de déviation isotopique entre les
métabolites de la testostérone et des composés endogènes de référence
(CER) issus de voies métaboliques différentes est supérieure en valeur
absolue à 3 ‰.
14. Rappeler ce qu’on appelle un isotope.
Deux isotopes ne diffèrent que par leur nombre de neutrons. Ils ont le même numéro atomique Z.
15. Donner l’équation de la réaction de combustion de la testostérone de formule brute C19H28O2.
C19H28O2 + 25O2 ---> 19 CO2 + 14 H2O.
16. En supposant cette réaction totale, quelle est la masse de CO2 obtenue par combustion de 100 mg de testostérone ?
M(testostérone) = 19 x12 + 28 +2 x16 =288 g/mol.
Quantité de matière de testostérone : n = 0,100 / 288 =3,47 10-4 mol.
n(CO2) = 19 n = 19 x 3,47 10-4 =6,6 10-3 mol.
Masse correspondante : m = 44 x6,6 10-3 =0,29 g ou 290 mg.
L’analyse par GC-C-IRMS d’un échantillon d’urine d’un athlète a donné entre autres les résultats suivants :
Composé endogène de référence : d13C = -20,1 ;
5Aen ( métabolite de la testostérone : d13C = -25,2.
17. Donner le rapport isotopique moyen du CER de cet athlète.
(25,2 -20,1) / 20,1 x1000~25,4 o/oo.
18. Peut-on conclure à l’administration de testostérone exogène pour cet athlète ?
25,4 o/oo > 3 o/oo, donc dopage.
|
|
|
|
Le
propionate de testostérone est un des esters synthétiques de la
testostérone les plus répandus, découvert en 1936 et utilisé pour la
première fois à des fins thérapeutiques en 1937. Il permet notamment de
traiter l’hypogonadisme, qui correspond à un défaut de testostérone
chez l’homme.
On donne les valeurs de solubilité dans l’eau à 25 °C des deux composés :
Testostérone : 23,4 mg/L. Propionate de testostérone : 1,48 mg/L.
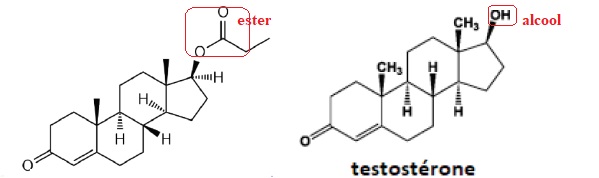
19. Expliquer la différence de valeur observée entre les deux composés.
Un ester est peu soluble dans l'eau ; un alcool ( le groupe OH est polaire) est plus soluble dans l'eau qu'un ester.
Les pictogrammes de sécurité associés au propionate de testostérone sont les suivants :

Danger ; cancérogène, mutagène.
Le propionate de testostérone peut être synthétisé par une réaction d’estérification.
21. Identifier le site nucléophile et le site électrophile mis en jeu dans l’étape 1.
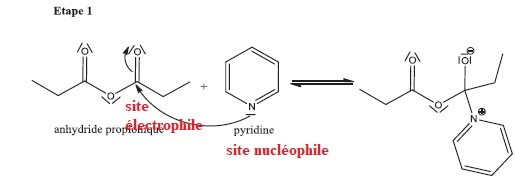
Addition sur la double liaison C=O.
22. Pour chaque
étape du mécanisme, identifier le type de réaction mis en jeu parmi la
liste suivante : addition, élimination, substitution, réaction
acido-basique.
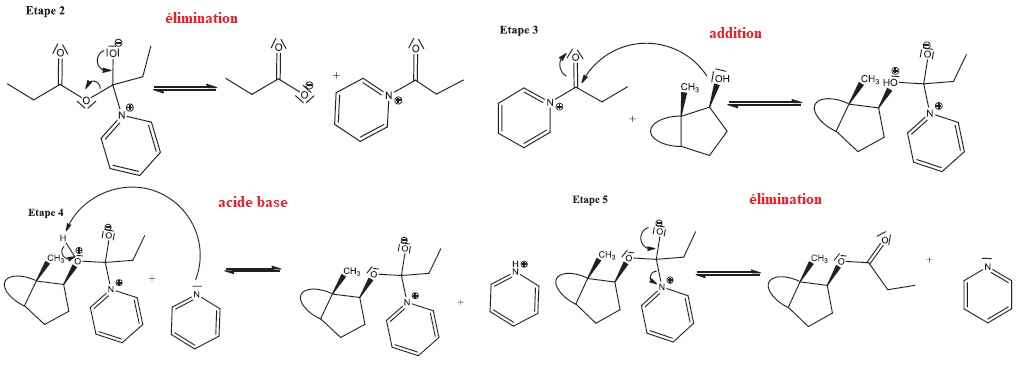
23. Dans ce mécanisme, en plus de son rôle de base, la pyridine est qualifiée de catalyseur nucléophile. Expliquer.
Un catalyseur accélère une réaction chimique. Il est régéné lors
de la dernière étape. La pyridine possède un doublet non liant : c'est
une base.
24. Écrire l’équation de la réaction d’estérification dont le mécanisme est donné ci-dessus.
C19H28O2 + C2H5COOH =C22H32O3 +H2O.
Une hydrolyse à l’aide d’une solution d’acide chlorhydrique dans
l’acétone conduit ensuite au propionate de testostérone. Pour cette
dernière étape, le protocole donné par les auteurs est le suivant :
Une goutte d’acide chlorhydrique à 36 % a été ajoutée à une solution de
200 mg du produit d’estérification, dans 2 mL d’acétone, puis le
mélange a été chauffé pendant 5 minutes dans un bain de vapeur. Une
dilution à l’aide d’eau a conduit à 170 mg de cristaux de température
de fusion 115-118 °C. Après recristallisation dans un mélange
éther/éther de pétrole, la température de fusion est de 121 °C.
25. Expliquer pourquoi l’ajout d’eau permet l’apparition de cristaux.
A 25°C la solubilité du propionate de testostérone est très faible 1,48 mg / L.
26. Proposer alors une méthode permettant d’isoler ces cristaux.
Filtration sous pression réduite.
27. Décrire le principe et la mise en oeuvre de la recristallisation, et justifier sa nécessité dans le protocole donné ci-dessus.
On dissout à chaud le produit à purifier dans un minimum de solvant
dans lequel les impuretés sont très solubles. A froid, le produit à
purifier cristallise. les impuretés restent dans le solvant.
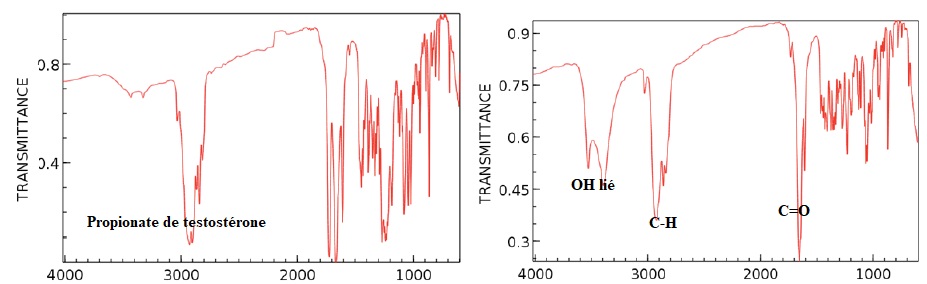
On donne ci-dessous deux spectres IR, l’un correspondant à la testostérone et l’autre au propionate de testostérone14.
28. Attribuer à
chaque molécule son spectre en justifiant la réponse et en attribuant
les principales bandes IR aux groupes fonctionnels correspondants.
Le propionate de testostérone est l’ester de testostérone ayant le plus court temps de demi-vie t1/2 (temps nécessaire pour que la concentration de substance présente dans l’organisme soit divisée par deux).
Le graphique ci-dessous présente l’évolution de la concentration
moyenne en propionate de testostérone dans le sérum de sept personnes
souffrant d’hypogonadisme, après injection d’une dose de composé.
L’élimination du propionate de testostérone peut être modélisée par une loi de décroissance exponentielle de la forme :
C(t) = C0e−kt où C(t) est la concentration à l’instant t, C0
la concentration à l’instant t=0 de la décroissance, c’est-à-dire la
concentration maximale atteinte par le composé, et k est une constante.
29. D’après la définition de t1/2 donner l’expression de C(t1/2) en fonction de C0.
C(t½) =0,5 C0 = C0e−kt½ ; 0,5 = e−kt½ ; ln(0,5) = -ln(2) = -kt½ : t½ = ln(2) / k.
30. Estimer la valeur du temps de demi-vie, noté t1/2, du propionate de testostérone à partir du graphique.
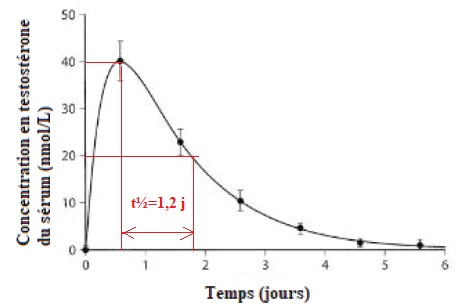
31. Estimer alors la valeur de k en précisant son unité.
k = ln(2) / 1,2 ~0,58 jour-1.
|
|
|