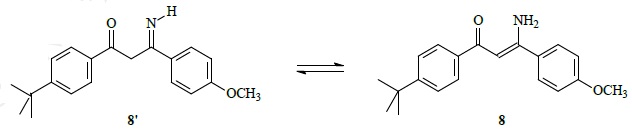Dans
les crèmes solaires..., Bts métiers de la chimie 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
La
nocivité des rayons solaires est dues aux UV, radiations dont les
longueurs d'onde sont comprises entre 100 et 400 nm. Les UV-C sont
absorbés par l'ozone atmosphérique.
1. Identifier,
parmi les UV-A et les UV-B ceux qui sont les plus énnergétiques.
Justifier les brûlures causées par les UV-B.
les UV-B ont des longueurs d'onde comprises enntre 280 et 350 nm. Les
UV-A ont des longueurs d'onde comprises entre 310 et 400 nm. Plus la
longueur d'onde est faible et plus le rayonnement est énergétique.
Les UV-B sont plus énergétiques que les UV-A.
Les UV-A sont plus pénétrants que les UV-B et cause cancers et
vieillissement de la peau. Les UV-B moins pénétrants sont la cause des
brûlures ( coup de soleil) et de cancers.
Partie I. La première lotion solaire.
2. Préciser si des précautions sont à prendre lors de la manipulation du salicylate de benzyle.
Ce produit provoque des irritations cutanées, une irritation sévère des yeux et peut irriter les voies respiratoires.
Il est de plus cancérogène, mutagène et reprotoxique
Porter des gants et un équipement de protection des yeux.
3. Donner la signification Téb = 168 - 170°C à 7 hPa. Commenter.
La température d'ébullition du salicylate de benzyle est voisine de 168°C sous une pression de 7 hPa.
Sous la pression atmosphérique et à 20°C, il se présente sous forme solide, puis liquide au delà de 26°C.
4. Indiquer si le salicylate de benzyle est plus soluble dans l'octan-1-ol ou dans l'eau.
Le coefficient de partage octan-1-ol / eau étant égal à 4, le
salicylate de benzyle est plus soluble dans l'octan-1-ol que dans l'eau.
5. Justifier la
nécessité d'utiliser une huile, constituant une phase organique, dans
la première formulation de la première lotion utilisée comme écran
solaire.
La formulation du produit doit prendre en compte le fait que le produit doit adhérer à la peau et résister à l'eau.
II. Les filtres solaires organiques.
6.
Indiquer le point commun entre les molécules. proposer une
justification au fait d'avoir choisi cette famille de molécules pour
les filtres organiques.
Ces molécules possèdent un grand nombre de liaisons doubles conjuguées
ainsi que des chromophores. En conséquence ces molécules sont très
stables et présentent un maximum d'absorption dans le domaine des UV-A
et UV-B.
7. Identifier et nommer les différents groupes caractéristiques de la molécule de DHHB.
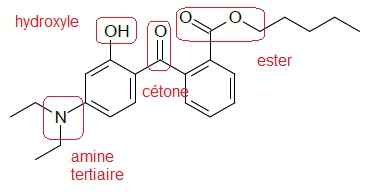
8. A température ambiante, le DPBT est beaucoup plus soluble dans l'eau que le DHHB. Expliquer.
Le DPBT possède 4 groupes sulfonate R-SO3-. Un composé ionique est plus soluble dans l'eau qu'un composé non ionique ( comme le DHHB).
Les filtres de type ß-dicétone comme l'avobenzone existent sous deux
formes, en équilibre. La forme cétone présente un maximum d'absorption
en UV ( 260 nm) et la forme énol à 357 nm.
Expliquer les différences d'absorption entre
la forme énol et la forme cétone et indiquer quelle est la forme active
dans ce filtre.
La forme énol est stabilisée du fait d'un plus grand nombre de doubles liaisons
conjuguées ainsi que par la formation d'une liaison intramoléculaire. 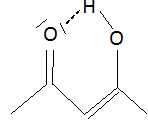 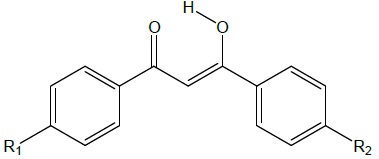
La forme active est la forme énolique qui absorbe dans le domaine des UV-A.
|
...
|
|
L'efficacité d'un filtre UV s'évalue par la valeur de la longueur d'onde au maximum d'absorption lmax mais aussi par l'intensité de cette absorption. On définit la valeur de l'absorption spécifique K en L g-1
comme le rapport entre la valeur de l'absorbance du filtre dissous et
la concentration en g / L dans un solvant donné, la longueur d'onde
étant fixée à lmax et l'épaisseur de la cuve fixée à 1,0 cm. K = A / C
Afin de déterminer la valeur K d'un filtre UV-B nommé EHT, une gamme
d'étalonnage a été réalisée à la longueur d'onde d'absorption maximale
( 315 nm). de plus, pour permettre une étude de linéarité, la gamme a
été effectuée pour p = 4 solution étalons ( Ci) avec n=3 répliques sur chaque mesures d'absorbance.
Ci mg / L
|
Absorbance à 315 nm
|
Essai 1
|
Essai 2
|
Essai 3
|
1,00
|
0,156
|
0,151
|
0,160
|
2,00
|
0,310
|
0,305
|
0,315
|
3,00
|
0,463
|
0,453
|
0,473
|
4,00
|
0,620
|
0,609
|
0,625
|
Régression linéaire A = 0,1545 C +0,0002 avec C en mg / L.
10. La statistique Fobs obtenue par la méthode de Fischer-Snedecor étant égale à 0,026, conclure sur la linéarité du modèle.
Fcritique = 6,06 ; Fobs < Fcritique, la linéarité est acceptée avec un niveau de confiance de 95 %.
11. Déterminer la sensibilité de la méthode et donner sa signification.
12. Déterminer la concentration à partir de laquelle l'EHT est détectée.
Limite de détection : LD = 3 s(b) / a.
a =0,1545 L mg-1 = 154,5 L g-1, coefficient directeur de la droite ; s(b)=0,0002 écart-type de l'ordonnée à l'origine.
LD =3 x0,0002 / 154,5 = 3,9 10-6 g / L
13. Déterminer la concentration à partir de laquelle l'EHT put être dosé par cette méthode.
Limite de quantification : LQ = 10 s(b) / a = 10 x0,0002 / 154,5 = 1,3 10-5 g / L.
14. Déterminer la valeur de l'absorption spécifique K de la molécule d'EHT et conclure quant à l'efficacité de ce filtre organique.
K = A / C ~154. Cette valeur étant supérieure à 100, ce filtre est efficace.
Synthèse de la benzocaïne au laboratoire.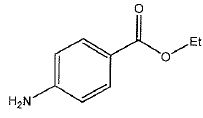
15. Identifier les réactifs mis en jeu dans chaque étape.
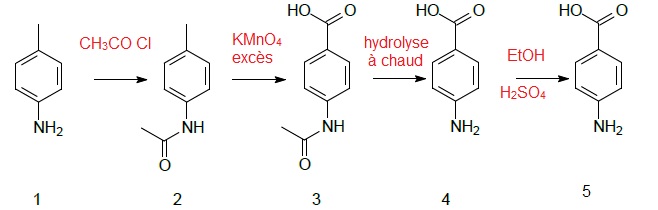
16. Justifier l'utilité des étapes 1 --> 2 et 3 -->4.
1 -->2 : protection de la fonction amine primaire en amide afin d'éviter l'oxydation de NH2 en NO2.
3 --> 4 : déprotection de la fonction amine avant l'estérification.
17. Déterminer la stoechiométrie da la réaction intervenant dans l'étape 2 --> 3 en écrivant l'équation de la réaction.
On note R : CH3 CO NH C6H5 -.
5 fois { R-CH3 + 2H2O --> RCOOH + 6 H+ + 6 e- }
6 fois { MnO4- + 8H+ + 5e- --> Mn2+ + 4H2O }
5R-CH3 + 10H2O +6MnO4- + 48H+ + 30e- ----> 5RCOOH + 30 H+ + 30 e- + 6Mn2+ + 24H2O
5R-CH3 + 6MnO4- + 18H+ ----> 5RCOOH + 6Mn2+ + 14H2O.
18. Dans le
protocole, 6,7 mmol de p-méthylacétanilide sont placés en présence de
16,5 mmol de permanganate de potassium. Est-ce en accord avec la
stoechiométrie ? Proposer une explication pour justifier les quantités
utilisées.
6,7 / 5 = 1,34 ; 16,5 / 6 = 2,75 ; l'ion permanagnate est en excès. Dans ces conditions l'oxydation est complète.
19. Adapter le
protocole pour un laborantin qui doit synthétiser de l'acide
p-acetamidobenzoïque à partir de 2,15 g de p-méthylacétamide.
M =135 g /mol.
Quantité de matière de p-méthylacétanilide n = 2,15 / 135 = 0,016 mol.
Quantité de matière de permanganate de potassium : 0,040 mol. Masse correspondante : 0,040 x 158 = 6,3 g.
a. Dissoudre 6,3 g de KMnO4 dans 40 mL d'eau bouillante. Mettre cette solution de côté.
b. Dans un erlenmeyer de 250 mL placé sur agitateur magnétique, ajouter 2,15 g de p-méthylacétanilide, 6 g de MgSO4, 7H2O et 150 mL d'eau.
c. Chauffer au bain
marie à 85°C en agitant vigoureusement cette solution, Ajouter
lentement, à l'aide d'une pipette la solution de permanganate de
potassium. L'addition devrait prendre environ 30 minutes. Il est
important que l'addition de permanganate soit lente et uniforme pour
éviter l'accumulation local d'oxydant.
d. Après avoir
ajouter l'oxydant, ajouter 5 mL d'éthanol sous agitation vigoureuse ;
porter à ébullition. Vérifier qu'il ne reste aucune couleur pourpre.
Filtrer sous vide en utilisant un tampon de Celite. Laver à l'eau pour dissoudre le produit adsorbé.
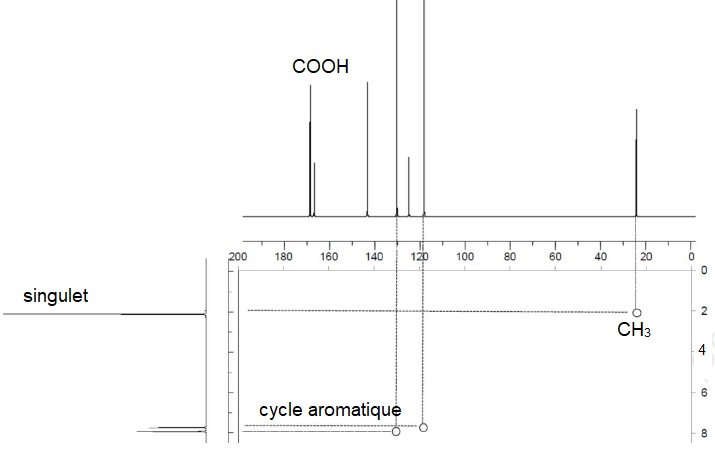
A la fin de la seconde étape de synthèse, le produit obtenu est analysé par RMN du proton.
20. En s'appuyant
sur ce spectre RMN, donner un argument justifiant que le technicien
décide de procéder à une purification du produit obtenu..
Vers 2 ppm, on distingue deux singulets corespondant à deux groupes CH3 différents. L'oxydation n'a donc pas été complète et le produit contient des traces de p-méthylacétanilide.
Après purification, une analyse par résonance magnétique nucléaire 2D est effectuée.
21. Vérifier la cohérence du spectre avec la structure attendue.
Biosynthèse d'un précurseur.
L'acide para-aminobenzoïque peut être obtenu en 2 étapes à partir
d'acide chorismique selon la voie suivante ( synthèse réalisée à 37°C
pendant une heure ).
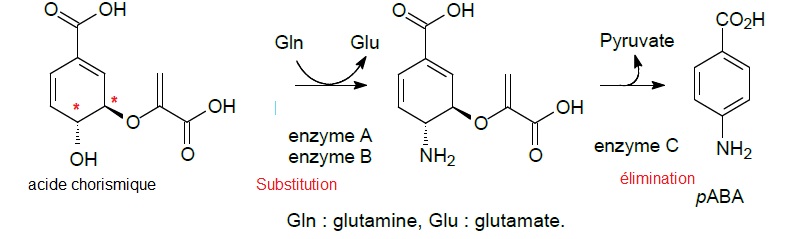
22. Qualifier chaque étape en utilisant les termes addition, élimination, substitution, insertion, transposition.
23. Indiquer en justifiant, le nombre d'atomes de carbone asymétriques dans la molécule d'acide chorismique.
2 atomes de carbone asymétrique, atome tétragonal lié à 4 atomes ou groupes d'atomes différents.
24. Indiquer un intérêt à réaliser la synthèse par voie enzymatique.
La synthèse enzymatique utilise moins d'énergie ( synthèse réalisée à 37°C ), on ne porte pas le milieu réactionnel à 85°C.
|
....
|
Dimensionnement d'un échangeur thermique pour la synthèse de la benzocaïne.
A
l'échelle industrielle, l'étape 4 --> 5 de la synthèse est réalisée
en portant à reflux le milieu réactionnel Les vapeurs, mélange
azéotropique eau - éthanol, arrivent en haut de la colonne et entrent
dans un condenseur tubulaire avec un débit de 25,3 L h-1.
Diamètre intérieur des tubes d = 44,0 mm ; longueur des tubes : L =
1,00 m ; nombre de tubes N = 10 ; coefficient global d'échange K = 178
W m-2 K-1.
Température d'entrée de l'eau : 20°C ; température sortie de l'eau 35°C
; température entrée azéotrope : 78,2°C; température sortie
azéotrope : 30°C.
Cp azéotrope : 2,67 kJ kg-1 K-1 ; densité azéotrope d = 0,80. Enthalpie massique de vaporisation de l'azéotrope :855 kJ kg-1.
25.Vérifier que le dimensionnement du condenseur est addapté.
Masse d'azéotrope par heure : 25,3 x0,80 = 20,24 kg .
Energie cédée par l'azéotrope par heure : 20,24 ( -855 +2,67 (30-78,2) =1,99 104 kJ.
Puissance thermique correspondante :1,99 104 / 3600 = 5,53 kW.
Surface latérale d'un tube : p d L = 3,14 x 0,0440 x1,00 = 0,434 m2 soit Séchange =1,38 m2 pour 10 tubes.
Puissance thermique échangée dans cet échangeur : K Séchange Dq.
Dq = [( 72,8 -30) -(35-20)] / ln [(72,8-30) / 35-20)] =27,8 /1,048 ~26,5.°C
Péchange = 178 x1,38 x 26,5 ~6,5 103 W = 6,5 kW.
Cette valeur étant supérieure à 5,53, l'échangeur est bien dimensionné.
Synthèse de l'avobenzone.
26. le 1,4-dioxane étant suspecté d'être cancérogène et trop coûteux, proposer en justifiant un solvant de substitution.
Le 1,4-dioxane et le dioxolane possédent des paramètres de solubilité proches Le dioxolane peut remplacer le 1,4-dioxane.
27. Calculer l'économie ainsi réalisée par cette substitution de solvant.
1,4-dioxane : 15 mL ; d= 1,03 ; 96 € / kg ; masse 0,015 x1,03 = 0,01545 kg ; 0,01545 x96 ~1,48 €.
dioxolane : : 15 mL ; d = 1,06 ; 48 € / kg. masse 0,015 x1,060,0159 kg ; 0,0159 x48 =0,76 €. Economie : 0,72 €.
28. Le schéma de synthèse entraîne la formation des isomères 8 et 8 '.
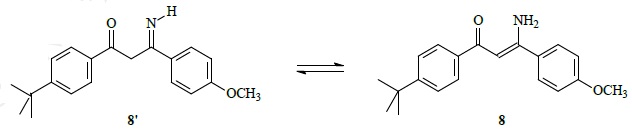
Proposer une technique d'analyse rapide à mettre en oeuvre permettant de mettre en évidence leur présence.
Réaliser un spectre d'absorption UV de 8 et 8'.
8 possède un plus grand nombre de doubles liaisons conjuguées, le
maximum d'absorption sera déplacé vers les plus grandes longueurs
d'onde (357 nm).
29. Les spectres d'absorption UV de 8 et de l'avobenzone sont semblables ( lmax ~356 nm ; log e= 4,4, range = 320 - 400 nm). Commenter la conséquence de la présence du sous-produit 8 dans ce filtre organique..
Il est possible de remplacer l'avobenzone par la molécule 8.
:
|
III. Les filtres solaires inorganiques.
Des pigments inorganiques tels TiO2 ou ZnO sont utilisés, soit seuls, soit en mélange avec des filtres organiques.
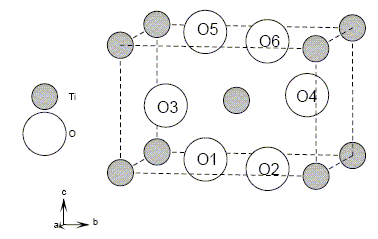
Le dioxyde de titane existe sous trois formes allotropiques : anatase d =3,88 ; brookite d = 4,12 ; rutile d = 4,25.
Afin de déterminer la nature d'un échantillon, deux analyses sont réalisées.
Une diffraction aux rayons X permet de trouver le volume de maille V = 62,43 10-30 m3.
Une mesure de densité est ensuite effectuée.
30. Identifier la forme allotropique sachant que la masse volumique se calcule à l'aide de la relation :r = n MTiO2 / (NAV).
n = 2 cations et 4 anions par maille.
r = 2 x(47,88 +32) 10-3/ (6,02 1023 x62,43 10-30) =4250 kg m-3 ou 4,25 g cm-3 ; d = 4,25. Il s'agit du rutile.
Le dioxyde de titane est utilisé comme filtre sous forme nanoparticulaire.
31. Proposer une
argumentation à fournir à un fabriquant de crème solaire quand au choix
de la taille la plus adaptée pour les nanoparticules.
Les particules de taille de l'ordre de 20 nm présentent un maximum d'absorption vers 300 nm (absorption faible des UV-B)..Les particules de taille de l'ordre de 50 nm présentent un maximum d'absorption vers 340 nm (absorption forte des UV-B).
Les particules de taille de l'ordre de 100 nm présentent un maximum d'absorption entre 300 et 400 nm (absorption forte des UV-A et des UV -B).
Les particules de taille 220 nm absorbe moyennement tout le spectre solaire.
Les particules de taille 100 nm offrent la meilleure protection..
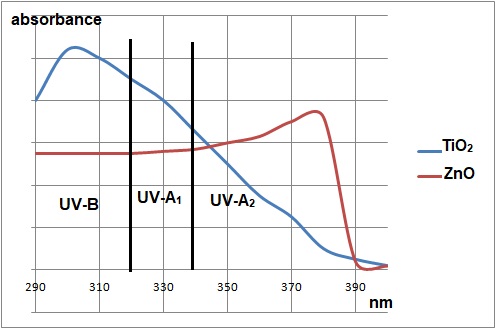
32. Déduire le caractère filtrant des pigments inorganiques.
Le dioxyde de titane absorbe fortement les UV-B et les UV-A1 mais faiblement les UV-A2.
ZnO absorbe moyennement les UV-B et les UV-A1. Il absorbe fortement une partie de UV-A2.
Les anti-oxydants des crèmes solaires.
33. Expliquer pourquoi un anti-oxydant doit avoir la propriété de s'oxyder rapidement.
Un anti-oxydant doit réduire rapidement les oxydants avant que ces derniers n'oxydent d'autres molécules.
Un technicien procède au titrage volumétrique par iodométrie de l'acide
ascorbique provenant de deux sources de matière première différentes.
Référence AOX_001 : matière première ayant conduit à une crème solaire conforme.
Référence AOX_002 : matière première ayant conduit à une crème solaire non conforme.
Il prépare une solution aqueuse d'acide ascorbique en dissolvant = 503 mg dans V = 100 mL d'eau.
Dans un erlenmeyer rodé il introduit EAA =20 mL de solution d'acide ascorbique et EI2 = 30 mL d'une solution de diiode de concentration CI2 = 48,64 mmol / L.
Rendre homogène, boucher et laisser reposer 15 min.
Doser l'excès de diiode par une solution de thiosulfate de sodium de concentration Cthio = 94,23 mmol / L.. V1thio = 19,00 mL.V1thio = 19,10 mL
34. Ecrire les équations des réactions se produisant avant le titrage, puis au cours du titrage.
Avant le titrage :couples oxydant réducteur :
C6H6O6 /
C6H8O6 ;
I2/ I- .
C6H8O6 - =
C6H6O6 +2H++
2e-.
I2 aq+2e- =2I-.
C6H8O6+ I2
aq= C6H6O6 + 2H+
+
2I-.(1)
Au cours du titrage :couples oxydant réducteur
: I2/ I- ;
S4O62-/
S2O32-.
I2+2e- = 2I-
réduction
2S2O32- =
S4O62- +2e-
oxydation
2S2O32-
+I2= S4O62- +
2I-
.(2)
35. Vérifier que la concentration en acide ascorbique présent en solution aqueuse est :
CAA1 = (CI2EI2 -0,5 Cthio V1thio) / EAA.
Quantité de matière de diode en excès :0,5 Cthio V1 thio.
Quantité de matière initiale de diiode : CI2EI2 .
Quantité de matière de diiode ayant réagi avec l'acide ascorbique : CI2EI2 -0,5 Cthio V1thio.
D'après les nombres stoechiométriques de (1) : CAA1 = (CI2EI2 -0,5 Cthio V1thio) / EAA.
36. Déterminer la concentration CAA1 de la solution 1 d'acide ascorbique avec une incertitude élargie relative de 1,0%. Pour le dosage effectué sr = 0,14 mmol / L en tenant compte d'un facteur d'élargissement k = 2.
CAA1 =(48,64 x30 -0,5 x94,23 x 19,00) / 20 =28,20 mmol / L.
CAA2 =(48,64 x30 -0,5 x94,23 x 19,10) / 20 =27,97 mmol / L.
28,20-27,97=0,23 ; 2,8 sr = 2,8 x0,14 =0,39 ; Résultat : (28,20 + 27,97) / 2 = 28,2 mmol / L.
37. Déterminer le degré de pureté de l'acide ascorbique du pot 1.
Soit 2,82 mmol dans 100 mL ou 2,82 M(acide ascorbique) = 2,82 x176,12 = 496,8 mg.
(503-496,8) / 503 =0,0126 ; 1-0,0126 =0,987 ( ~98,7 %).
En effectuant un titrage similaire pour le pot n°2, on trouve une pureté de 82,5 %.
38 Conclure et proposer des actions correctives concernant le stockage de l'acide ascorbique.
Stockage dans un endroit frais, sec ; récipient bien fermé, à l'abri de la lumière.
|
|
|