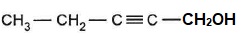Viticulture
: réfractométrie, bouillie bordelaise, phéromones, Bts
biotechnologie 2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Utilisation d'un réfractomètre d'Abbe en viticulture (13 points)
C'est un instrument utilisé pour prévoir le degré alcoolique d'un vin à
partir de la mesure de l'indice de réfraction du jus de raisin.
1. Principe de fonctionnement d'un réfractomètre d'Abbe.
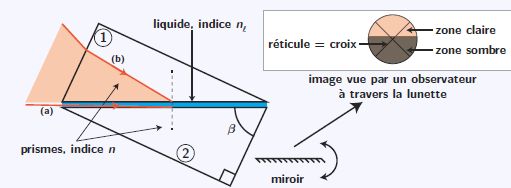
Il est constitué de deux prismes en verre d'indice n= 1,700 ( pour la raie D du sodium ) entre lesquels est
positionné un mince film de liquide issu du raisin dont on veut mesurer
l'indice de réfraction nl.
Angle ß = 60 °.
Le prisme d'entrée (1) est accolé à une lampe à vapeur de sodium et permet d'éclairé le liquide en incidence rasante ( rayon(a)).
Les rayons traversant le prisme (2) sont envoyés sur un miroir dont on peut contrôler l'inclinaison.
Après réflexion, ces rayons sont alors observés par l'utilisateur à
l'aide d'une lunette ; l'observateur règle la position du miroir de
sorte à placer la limite de séparation entre la zone claire et la zone
sombre au centre du réticule ( croix).
1.1. Un prisme est un milieu dispersif. Définir ce qu'est un milieu dispersif.
Dans un milieu dispersif, la célérité des ondes dépend de la fréquence de l'onde.
1.2 On s'intéresse
à deux radiations de la lumière blanche : une radiation bleue et
une radiation rouge. Lors du passage à travers le prisme, la radiation
bleue est la plus réfractée. Justifier cette affirmation sans calcul à
l'aide de la loi de Cauchy.
n = A + B / l2 avec A et B positifs.
La longueur d'onde du bleu est inférieure à celle du rouge, donc nbleu > nrouge.
Loi de Descartes pour la réfraction : nair sin i = nprisme sin r.
Pour un même angle d'incidence i : sin i = nbleu sin r bleu ; sin i = nrouge sin r rouge ;
sin r bleu = nrouge / nbleu sin r rouge ; nrouge / nbleu < 1 donc sin r bleu < sin r rouge .
1.3. Indiquer pourquoi la lumière blanche semble à priori inadaptée à la mesure de l'indice de réfraction d'un échantillon.
La lumière blanche est polychromatique ; l''indice de réfraction du verre dépend de la longueur d'onde.
1.4 Citer l'élément du réfractomètre permettant néanmoins de travailler en lumière blanche.
Le prisme supérieur permet d'obtenir un éclairage rasant, l'angle d'incidence i vaut 90°.
2. Détermination du degré alcoolique d'un vin par réfractométrie.
Pour obtenir la mention " sélection grains nobles", un vin doit
afficher un pourcentage en volume d'alcool supérieur ou égal à 16,6 %.
Une teneur de 17 g / L de sucres dans le jus de raisin conduit à une
teneur en alcool de 1 % en volume après fermentation alcoolique totale.
Une goutte de jus de raisin est déposée entre les prismes du
réfractomètre. Lorsque la lumière blanche arrive en incidence rasante
sur le prisme inférieur, le rayon réfracté ne peut dépasser une valeur
maximale correspondant à l'angle de réfraction limite ir2 tel que :
sin i2 = njus / nprisme.
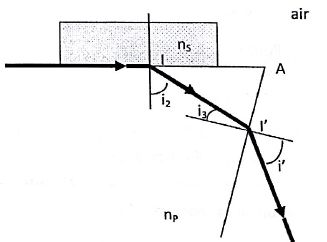 2.1. On mesure à la sortie du prisme un angle i' = 9,98°.
2.1. On mesure à la sortie du prisme un angle i' = 9,98°.
Calculer la valeur de l'angle i3 au point I'. En déduire que i2 = 54,15°. Calculer njus.
Au point I' : nair sin i' = nprisme sin i3 ; sin i3 = sin i' / nprisme = sin 9,98 / 1,700 =0,1019 ; i3 =5,851 °.
(Dans le triangle AII' : 90-i2 + 90-i3 +60 = 180 ; i2 =60-i3 =60-5,85 =54,15°.
njus = nprisme sin i2 = 1,700 x sin (54,15) =1,378.
2.2. Ce vin peut-il obtenir la mention " sélection grains nobles " ?
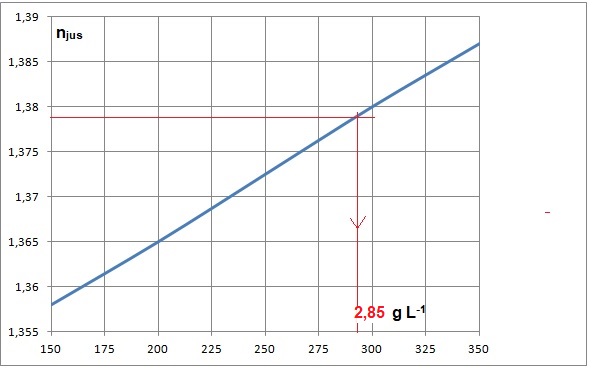
285 / 17 ~16,8 % en volume d'alcool après fermentation totale.
Cette valeur est supérieure à 16,6 % : ce vin obtient cette mention.
|
...
|
|
II. la bouillie bordelaise pour protéger la vigne
La bouillie bordelaise est utilisée pour lutter contre le mildiou. Cette bouillie est un mélange de chaux solide Ca(OH)2 et de sulfate de cuivre solide CuSO4.
1. Dosage de la bouillie bordelaise par titrage indirect.
l'étiquette d'un paquet de bouillie bordelaise indique un pourcentage
massique de 20 % en sulfate de cuivre. On souhaite vérifier cette
indication.
La solution S est préparée en dissolvant 1,00 g de bouillie bordelaise
dans 100 mL d'eau distillée. l'ajout d'un large excès d'iodure de
potassium solide KI à la solution S provoque la formation de l'ion
complexe incolore diiodocuprate(I) [Cu(I2]- aqueux et de diiode I2 aq.
L'équation de cette réaction supposée totale s'écrit :
2Cu2+aq + 6 I-aq ---> I2aq +2[Cu(I2]- aq. (1).
La solution S' est limpide et de couleur brune.
On réalise le titrage colorimétrique du diiode contenu dans la
solution aqueuse S' par une solution titrante de thiosulfate de sodium
2Na+ aq + S2O32-aq de concentration C = 2,00 10-2 mol / L. Le volume de solution S' dosé est VS' = 25,0 mL et le volule de solution titrante versée à l'équivalence est VE = 15,60 mL.
Toutes les espèces chimiques mises en jeu sont incolore à l'exception du diiode.
1.1. Des
recherches menées par l'INRA ont permis de développer des plants de
vignes comportant plusieurs gènes de résistance au mildiou.
Indiquer en quoi les pictogrammes suivants fournissent un élément de justification du travail de recherche réalisé par l'INRA.

Le sulfate de cuivre présente un danger pour l'environnement.
1.2. Indiquer la verrerie nécessaire à la réalisation de ce titrage.
Burette graduée de 25 mL, becher ou erlenmeyer, pipette jaugée.
1.3. Etablir en détaillant la démarche l'équation de la réaction de titrage.
Réduction du diiode : I2 aq + 2e- = 2I-aq.
Oxydtion de l'ion thiosulfate : 2S2O32- aq = S4O62- aq+2e-.
Ajouter et simplifier : 2S2O32- aq + I2 aq= S4O62- aq+2I-aq.
1.4. Indiquer comment est repérée l'équivalence.
Avant l'équivalence, le diiode est en excès (solution
brune) ; après l'équivalence le diiode est en défaut ( solution
incolore).
1.5. Ecrire la relation entre les quantités de matière de diiode et d'ion thiosulfate à l'équivalence.
n(thiosulfate) = 2 n(I2) ; C VE = 2 VS' [I2].
1.6. Vérifier que la quantité de matière de diiode est 1,56 10-4 mol.
n(I2) = 0,5 x15,60 10-3 x2,00 10-2 = 1,56 10-4 mol.
L'équation (1) permet d'écrire la relation suivante : n(I2) = 0,5 n(Cu2+).
1.7. Calculer la masse m de sulfate de cuivre (II) dans 100 mL de la solution S.
M(CuSO4) = 63,5 +32 + 4 x16=159,5 g /mol.
m =159,5 x 1,56 10-4 x 2 =0,0498 g dans 25 mL de S' soit 0,0498 x4 = 0,199 g dans 100 mL.
1.8. Déterminer le pourcentage massique de sulfate de cuivre dans la bouillie bordelaise. Conclure.
0,199 g de sulfate de cuivre dans 1,00 g de bouillie bordelaise soit 19,9 %, valeur en accord avec l'indication de l'étiquette.
2. Dosage de la bouillie bordelaise par spectrophotométrie.
La solution aqueuse S de bouillie bordelaise préparée dans la partie 1 est quasiment incolore.
Pour réaliser le dosage spectrophotométrique par étalonnage des ions
cuivre (II), on ajoute à la solution S une solution aqueuse
d'ammoniaque NH3 aq afin d'obtenir une solution de couleur bleue céleste due à la formation de l'ion [Cu(NH3)4]2+aq.
2.1. Ecrire la structure électronique de l'atome d'azote.
1s2 2s2 2p3.
2.2. Ecrire la formule de Lewis de la molécule d'ammoniac.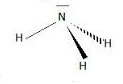
2.3. Expliquer pourquoi l'ammoniac peut jouer le rôle de ligand.
L'ammoniac possède un doublet d'électrons non liant.
2.4. Justifier la couleur de l'ion complexe formé.
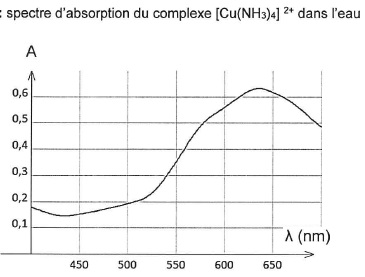
Cet ion complexe présente un maximum d'absorption vers 625 nm ( jaune
orangé). La solution possède la couleur complémentaire du jaune orangé
soit le bleu.
2.5. Nommer la loi utilisée dan un dosage spectrophotométrique.
Loi de Beer - Lambert.
|
....
|
Les phéromones contre les chenilles nuisibles de la vigne.
Les phéromones sont des molécules supports de la communication propre à
une espèce. Les diffuseurs de phéromones sexuelles de synthèse
d'eudémis femelles sont utilisées dans les vignes pour désorienter les
mâles.
1. Stéréochimie de phéromones d'insectes.
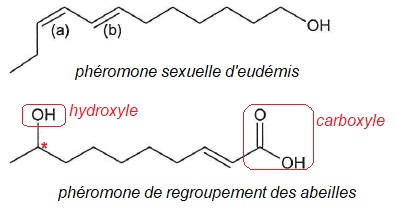
1.1.Déterminer la stéréochimie des doubles liaisons notées (a) et (b) de la phéromone d'eudémis. Justifier.
(a) : les deux groupes les plus importants sont du même côté ( isomère Z).
(b) : les deux groupes les plus importants sont de part et d'autre, en opposition ( isomère E).
1.2, 1.3
Dans la formule de la phéromone de regroupement des abeilles, entourer
et nommer les groupes fonctionnels et justifier la chilarité de la
molécule.
La molécule possède un atome de carbone asymétrique, elle est chirale.
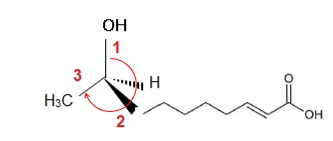
1.4 Donner la représentation de Cram de l'énantiiomère de configuration R en justifiant brièvement.
2. Synthèse de la phéromone sexuelle d'eudémis.
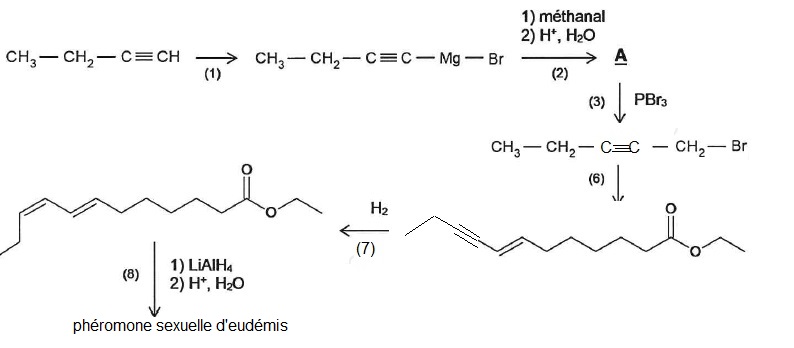
2.1. Indiquer la polarité de la liaison C-Mg en justifiant.
Le carbone est plus électronégatif que le magnésium. Ce dernier porte
une charge partielle positive et le carbone porte une charge partielle
négative.
2.2. Ecrire la formule développée du méthanal.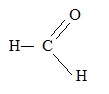
2.3. Donner la formule semi-développée de A.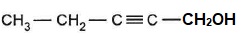
2.4. Le spectre infrarouge de A présente une large bande vers 3300 cm-1. Identifier la liaison ainsi caractérisée.
Liaison O-H associée par liaison hydrogène.
2.5. Indiquer la modification de la molécule qui a lieu à l'étape 7.
Réduction de la liaison triple carbone carbone en liaison double carbone carbone.
2.6. Proposer un catalyseur adapté à l'étape 7. Justifier.
Catalyseur de Lindlar, palladium. Ce catalyseur n'est pas suffisamment actif pour réduire l'alcyne en alcane.
2.7. Indiquer si l'étape 8 est une réaction d'oxydation ou de réduction. Justifier.
Réduction de la fonction ester en alcool primaire.
|
|