Energie
thermique marine, valorisation des eaux profondes,
bac STI2D STL Polynésie 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Partie A –Principe de l’ETM
.
Principe physique.
1. Choisir le type
de transfert thermique intervenant entre l’eau de mer et la paroi
solide de l’évaporateur parmi les termes convection, conduction, ou
rayonnement. Justifier la réponse par une phrase.
Le transfert thermique intervenant entre
l’eau de mer et la paroi solide de l’évaporateur s'effectue par
conduction.
2. Préciser dans quel sens
s’effectue ce transfert thermique.
L'eau de mer chaude cède de l'énergie au fluide calopoeteur NH3.
3. Placer les
points de fonctionnement nommés E et S correspondant respectivement à
l’entrée et à la sortie de l’évaporateur.
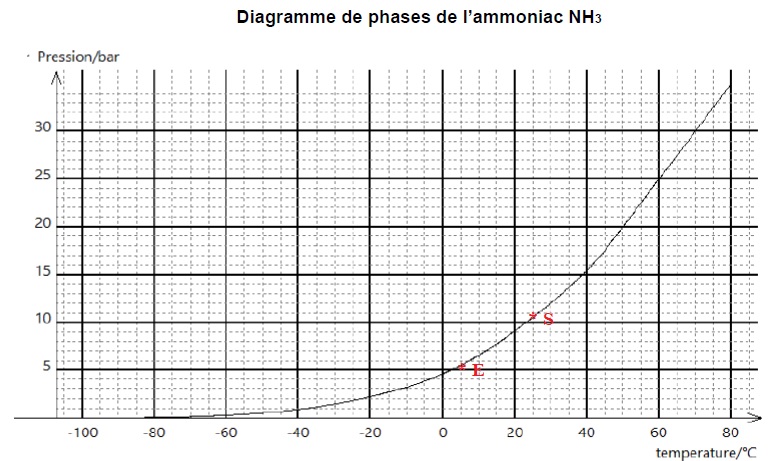
4. Nommer la
transformation physique subie par l’ammoniac NH3 dans
l’évaporateur.
Vaporisation.
Le transfert thermique
Le débit massique Dm de l’eau de mer chaude prélevée par la
conduite de l’évaporateur est égal à 3000 kg·s-1 et la
capacité thermique massique cmer de l’eau de mer, supposée
indépendante de sa température, vaut 4,00×103 J⋅kg−1⋅°C−1.
5. Vérifier que
l’énergie thermique Q échangée par l’eau de mer chaude en une seconde a
pour valeur - 6,0×107 J.
Q = Dm cmer Dq = 3000 x4,00 103
x(21-26)= - 6,0×107 J.
6. Donner la signification de la
valeur négative de l’énergie thermique Q.
L'eau chaude cède de l'énergie à l'ammoniac.
7. Expliquer en une
phrase ce que représente la grandeur ΔHvap.
C'est l'énergie ( enthalpie molaire ) qu'il faut fournir à une mole
d'ammoniac pour la faire passer de l'état liquide à l'état gazeux.
8. Sachant que dans
les conditions de pression et de température de ce sujet l’enthalpie
molaire de vaporisation ΔHvap de l’ammoniac a pour valeur -
27,6 kJ⋅mol-1, déterminer la quantité de matière n
d’ammoniac vaporisée chaque seconde ; on supposera que le transfert
thermique entre l’eau et l’évaporateur s’effectue sans perte.
n =6,0×107 / (2,76 104)
=2,17 103 ~2,2 103 mol.
Choix de la profondeur.
L'océan tropical est un vaste capteur d'énergie solaire et ses eaux de
surface constituent un immense réservoir d’énergie. Le document ruivant
indique l’évolution de la température de l’eau des océans en fonction
de la profondeur.
9. Indiquer
clairement la profondeur approximative à laquelle devra être effectué
le prélèvement d’eau froide pour obtenir une température de 5°C.
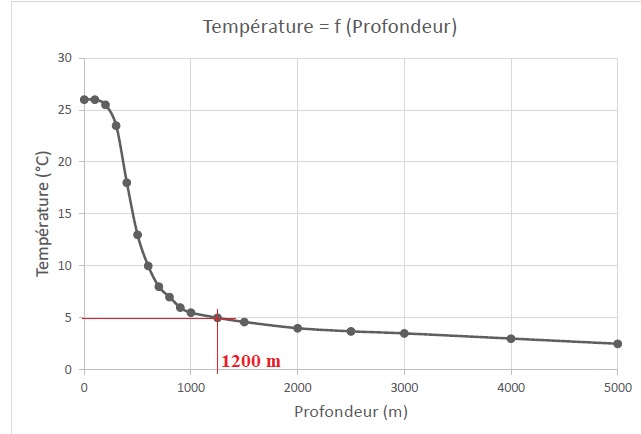
10. Vérifier que le différentiel de température est suffisant pour que l’installation soit rentable.
26-5 =21°C, valeur supérieure à 20°C.
|
...
|
|
Partie B - Prélevement des eaux froides.
Étude dynamique.
11. En utilisant la
relation donnant l’aire d’un disque, calculer la surface S de la
section d’une canalisation en PEHD, en conservant trois chiffres
significatifs.
Diamètre Dmaxi =2,0 m.
S = p R2=3,14 x 1,02 = 3,14 m2.
12. Calculer le débit volumique réel Dv de l’eau dans une canalisation de la station ETM de Saint Rose.
Vitesse de l'eau v = 1,2 m /s.
Débit volumique Dv =S v = 3,14 x1,2 =3,77 ~3,8 m3 /s.
13. En utilisant le
débit volumique Dv réel calculé précédemment, vérifier que la puissance
P réellement délivrée par une installation comportant 5 canalisations
est égale à 6,3 MW.
Un débit d’eau froide profonde de l’ordre de 3,0 m3·s-1 permet d' obtenir une puissance produite égale à 1,0 MW.
3,77 x5 = 18,85 m3 /s.
18,85 / 3 ~6,3 MW.
14. Les
canalisations utilisées ne conservent pas forcément le même diamètre
tout au long de l’installation. Les conduites de deux mètres de
diamètre tendent à se rétrécir avant leurs arrivées sur le site de
Sainte Rose.
En considérant que le débit reste constant, calculer la vitesse v d’écoulement dans une canalisation de rayon r égal à 25 cm.
Le rayon étant divisé par 4, la section est divisée par 16 et la vitesse est multipliée par 16.
1,2 x16 =19,2 ~19 m /s.
La bathymétrie (sondage de la profondeur).
15. Déterminer la période T du signal émis par l’émetteur du bateau.
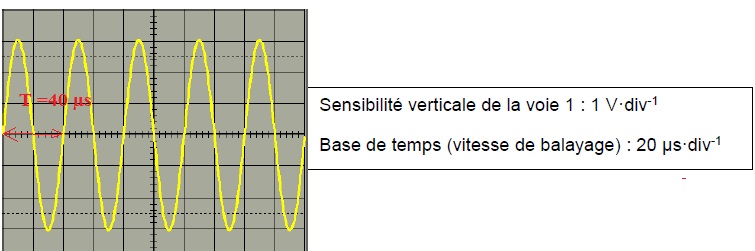
16. Calculer sa fréquence f.
f = 1 /(40 10-6) =2,5 104 Hz = 25 kHz.
17. Déterminer la nature de l’onde émise.
Valeur supérieure à 20 kHz, domaine des ultrasons.
18. Indiquer, par une double flèche et par le symbole Δt, le temps de propagation de l’impulsion.
19. Vérifier, à l’aide d’un calcul, que ce temps de propagation Δt a pour valeur 1,6 s.
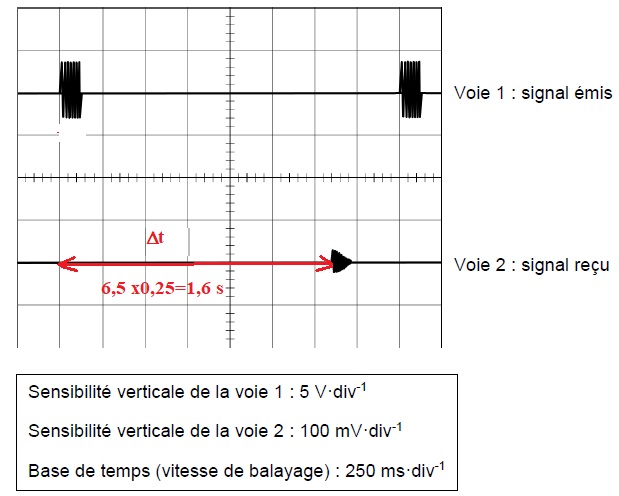
20. Calculer la distance d à laquelle se trouve le fond marin où sera prélevée l’eau froide.
cson = 1500 m /s ; distance = 1500 x1,6 / 2 =1200 m.
21. La pression au niveau de la surface de l’océan correspond à la pression atmosphérique Patm égale à 1,02 x103 hPa. Déterminer la pression hydrostatique P à une profondeur de 1200 m.
P = Patm + r g H =1,02 105 +1033 x 9,81 x1200 =1,23 107 Pa.
|
....
|
Partie C : Valorisation des eaux profondes.
En sortie de la centrale ETM, l’eau de mer froide est à une température
d’environ 10°C. L’intérêt serait de valoriser cette eau à travers de
nouvelles activités, ce qui permettrait de réduire les coûts des
installations. En effet, l’eau de grande profondeur présente trois
atouts principaux :
- une température basse,
- une bonne qualité microbiologique,
- une richesse en éléments minéraux.
L’une des applications envisagées consisterait à utiliser cette eau
fertile pour élever des algues en photo-bioréacteurs (algoculture). Ces
algues microscopiques peuvent être utilisées directement pour la
synthèse d’un biocarburant : le biodiesel.
L’algoculture.
Lors de la photosynthèse, grâce à la lumière, les algues consomment le dioxyde de carbone CO2 pour produire du dioxygène O2 mais aussi de la matière organique (glucides, lipides…). Elles peuvent donc produire un carburant « vert ».
En effet, la majeure partie de l'énergie stockée dans les algues l’est
sous forme de lipides (triglycérides d’acides gras) qui, après réaction
avec du méthanol, peuvent être utilisables comme carburant appelé EMAG
(esters méthyliques d’acide gras). Contrairement au biocarburant issu
de cultures oléagineuses (maïs, colza…), ce biodiesel ne détourne pas
l’usage des terres agricoles, habituellement utilisées pour des
cultures alimentaires, au profit de la production de carburant.
22. Indiquer les
aspects de la production d’algues marines en photo-bioréacteurs qui
semblent prometteurs au plan économique ou écologique.
Fixation du CO2 ; production de carburant vert sans utiliser de terres agricoles.
23. Le biodiesel (EMAG) a pour formule brute C17H34O2 et sa combustion complète produit du dioxyde de carbone et de la vapeur d’eau.
Recopier l’équation de la réaction de combustion complète ci-dessous sur la copie, la compléter et l’ajuster.
2 C17H34O2 + 49 O2 --->34 CO2 + 34 H2O.
24. Montrer que la quantité de matière n contenue dans une masse m de biodiesel valant 1,0 kg est voisine de 3,7 mol.
On donne la masse molaire moléculaire de l’EMAG : M(C17H34O2) = 270 g.mol-1.
n = 1000 / 270 =3,7 mol.
25. Montrer que la quantité de matière n(CO2)
de dioxyde de carbone produite par la combustion d’un kilogramme de
biodiesel est voisine de 63 mol. Compléter le tableau suivant.
n(CO2) = 34 n / 2 = 17 n = 17 x3,7 ~ 63 mol
26. Calculer la masse mCO2
de dioxyde de carbone produite par la combustion complète d’un
kilogramme de biodiesel sachant que la masse molaire du dioxyde de
carbone M(CO2) vaut 44 g.mol-1.
mCO2 =44 x63 ~2,77 103 ~2,8 103 g ~2,8 kg.
27.
Sachant que la combustion d’un kilogramme de diesel classique produit
3,1 kilogrammes de dioxyde de carbone, calculer la masse de dioxyde de
carbone économisée par la combustion d’un kilogramme de biodiesel, par
rapport à celle du diesel classique. Commenter le résultat obtenu.
3,1 -2,8 = 0,3 kg ou (0,3 / 3,1 x100 ~10 %.
Cette économie n'est pas négligeable.
Nettoyage du bioréacteur.
Les photo-bioréacteurs sont des tubes transparents qui s’opacifient à
cause de la présence de calcaire dans l’eau de mer. Un nettoyage
chimique à base d’acide phosphorique est donc préconisé.
28. Préciser les précautions d’usage de ce produit.
Produit corrosif, port de blouse, gants et lunettes de protection.
29. Nommer la famille des espèces chimiques capables de capter un proton H+.
Bases.
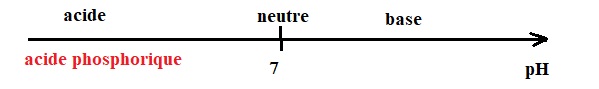
30. Sur une échelle
de pH graduée de 0 à 14, indiquer dans quel intervalle se situe une
solution acide, une solution basique, une solution neutre ; positionner
le produit de nettoyage dans un de ces intervalles.
31. Détailler le protocole expérimental à suivre pour préparer un volume de 250,0 mL de solution diluée à 20 % en volume (ou au 1/5ème) de bio-détartrant ; préciser le matériel de laboratoire utilisé parmi la liste ci-dessous et les volumes mis en oeuvre.
Facteur de dilution = 1 / 0,20 = 5.
Prélever 250 / 5 = 50,0 mL se solution mère à l'aide d'une pipette jaygée de 50,0 mL.
Placer dans une fiole jaugée de 250 mL contenant 1 /3 d'eau distillée.
Compléter jusqu'au trait de jauge à l'aide d'eau distillée.
Boucher, agiter pour rendre homogène.
32. Indiquer comment évolue la concentration des ions H3O+(aq) si on ajoute de l’eau à la solution pure initiale. Préciser dans quel sens évolue le pH.
La concentration des ions H3O+(aq) diminue lors d'une dilution et le pH de la solution augmente.
33. L’acide phosphorique fait partie du couple acide/base H3PO4(aq) / H2PO4-(aq).
Écrire l’équation modélisant la réaction acido-basique entre l’acide phosphorique et l’eau qui appartient au couple acide/base H3O+(aq) / H2O(l) ; préciser l’espèce chimique qui capte un proton H+.
L'eau est une base ; elle capte un proton.
H3PO4(aq) +H2O(l) = H2PO4-(aq) +H3O+(aq).
|
|