La
fluorescéine,
bac S Liban 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
1. Propriétés spectroscopiques.
On donne le diagramme de prédominance des différentes formes de la fluorescéine.
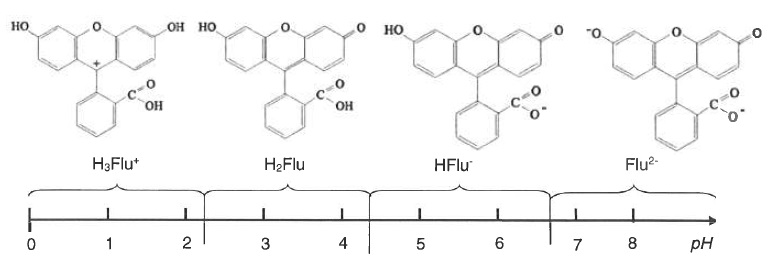
1.1. Identifier les différents couples acide / base et estimer leur pKa.
H3Flu+ / H2Flu : pKa ~ 2,3. H2Flu / HFlu- : pKa ~ 4,4. HFlu- / Flu2-: pKa ~ 6,7.
1.2. On réalise une solution aqueuse S0 en dissolvant 1,00 10-2 g de fluorescinate de sodium FluNa2 dans 100 mL d'eau déminéralisée.
1.2.1. Ecrire l'équation de la réaction de dissolution. En déduire la concentration molaire apportée en ion Flu2+.
FluNa2(s) ---> 2 Na+aq + Flu2-aq.
Quantité de matière FluNa2(s) : 1,00 10-2 / M( FluNa2) = 1,00 10-2 / 376 = 2,66 10-5 mol.
Quantité de matière d'ion Flu2-(aq) : 2,66 10-5 mol.
[Flu2-]0 = 2,66 10-5 / 0,100 = 2,66 10-4 mol / L.
1.2.2. Ecrire l'équation de la réaction des ions Flu2+ avec l'eau. De quel type de réaction s'agit-il ?
Réaction acide base : Flu2-aq +H2O(l) = HFlu- aq +HO-aq.
1.2.3. Justifier la relation suivante :[Flu2- ] =[Flu2-]0 -[HFlu- ].
Conservation de l'espèce Flu : concentration en solution à l'équilibre
= concentration apportée diminuée de celle ayant réagi avec l'eau à
l'équilibre.
1.2.4. En déduire la concentration molaire en ion HFlu- à l'équilibre , pour un pH égal à 7,0
pH = pKa + log ([Flu2- ] / [HFlu- ]).
pH = pKa + log (([Flu2-]0 -[HFlu- ]) / [HFlu- ]).
log (([Flu2-]0 -[HFlu- ]) / [HFlu- ]) = pH-pKa = 7,0 -6,7 = 0,3 ;
([Flu2-]0 -[HFlu- ]) / [HFlu- ] = 100,3 ~ 2.
[Flu2-]0 -[HFlu- ] =2 [HFlu- ] ; [HFlu- ] = [Flu2-]0 / 3 ~2,66 10-4 / 3 ~ 8,9 10-5 mol / L.
1.2.5. Ce résultat est-il en accord avec le diagramme de prédominance.
Oui, à pH =7, supérieur à pKa ( 6,7), la forme Flu2- prédomine.
1.3. Pour obtenir
une solution aqueuse de fluorecence maximale, on réalise le spectre
d'absorption et d'émission en absorbance de la fluoresceine sous la
forme Flu2- dans une solution aqueuse d'hydroxyde de sodium de concentration molaire 0,01 mol / L.
1.3.1 Vérifier que le pH de la solution d'hydroxyde de sodium est égal à 12.
pH = 14 + log ( HO-] = 12 + log (0,01) = 12.
1.3.2 Cette solution permet-elle d'assurer une fluorescence maximale ? Argumenter.
pH = pKa + log([Flu2- ] / [HFlu- ] ) ; log([Flu2- ] / [HFlu- ]) = pH-pKa = 12-6,7 = 5,3 ; [Flu2- ] / [HFlu- ] = 105,3 ;
[Flu2- ] / [HFlu- ] ~ 2 105.
A pH = 12, la fluorescéine est essentiellement sous la forme Flu2-, espèce la plus fluorescente.
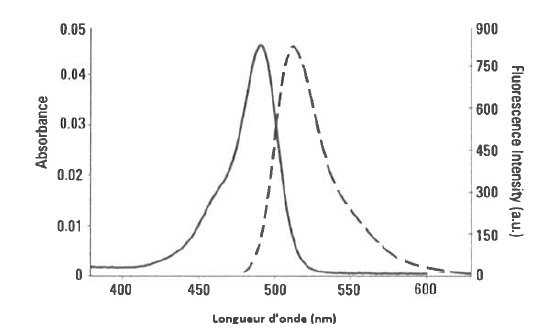
1.3.3. Quelle courbe de la figure correspond au spectre d'absorption sachant qu'elle absorbe dans le bleu et fluoresce dans le vert.
Longueur d'onde du bleu : 470 nm ; ce qui correspond au maximum d'absorption de la courbe en trait plein.
Longueur d'onde du vert 530 nm ; ce qui correspond au maximum de la courbe en trait pointillé.
1.3.4. L'eau de la source du Lez a un pH = 8,3. Le suivi fluorimétrique du cours d'eau est-il envisageable ? Justifier.
pH = pKa + log([Flu2- ] / [HFlu- ] ) ; log([Flu2- ] / [HFlu- ]) = pH-pKa = 8,3-6,7 = 1,6 ; [Flu2- ] / [HFlu- ] = 101,6 ;
[Flu2- ] / [HFlu- ] ~ 40.
A pH = 8,7, la fluorescéine est essentiellement sous la forme Flu2-, espèce la plus fluorescente. Le suivi fluorimétrique est envisageable.
|
|
|
1.4. On réalise une solution aqueuse S0 de volume 100,0 mL par dissolution de 1,00 10-2 g de fluorescinate de sodium. En diluant la solution par 10, on obtient la solution S1 dont le pH est ajusté au dessus de 9. Trois solutions S2, S3 et S4 sont fabriquées de façon analogues. On mesure l'absorbance des différentes solutions à une longueur d'onde appropriée.
Solution
|
S1
|
S2
|
S3
|
S4
|
C(mol / L)
|
2,68 10-5
|
2,01 10-5
|
1,34 10-5
|
6,70 10-6
|
A
|
1,523
|
1,200
|
0,811
|
0,411
|
1.4.1 Rédiger le protocole de dilution pour préparer S1 à partir de S0.
Prélever 10,0 mL de S0 à l'aide d'une pipette jaugée e 10,0 mL. Placer
dans une fiole jaugée de 100,0 mL et compléter avec de l'eau distillée
jusqu'au trait de jauge. Agiter pour rendre homogène.
1.4.2 A quelle longueur d'onde faut-il réaliser le dosage spectrophotométrique ?
Pour une meilleure précision, on se place au maximum d'absorption 470 nm.
1.4.3 Montrer que les mesures sont en accord avec la loi de Beer-Lambert.
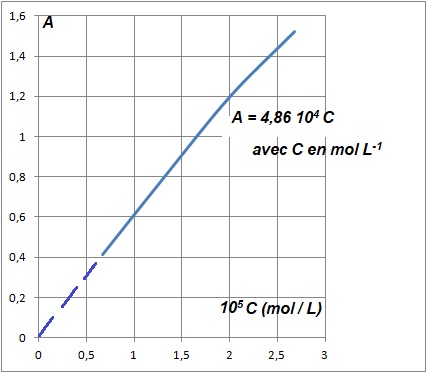
La courbe d'équation A = f(C) est une droite passant par l'origine. Les mesures sont en accord avec la loi de Beer-Lambert.
1.4.5 En déduire la
valeur du coefficient d'extinction molaire e pour la forme prédominante
de la fluorescéine à ce pH. ( largeur de la cuve : 1 cm.
e L = 4,86 104 ; e = 4,86 104 L mol-1 cm-1.
|
|
|
|
2. Synthèse de la fluorescéine.
a. Broyer 3,30 g de résorcine et 2,00 g d'anhydride phtalique.
b. Les introduire dans un ballon de 100 mL et placer l'ensemble dans un bain d'hule thermostaté à 180°C.
c. Ajouter quelques gouttes d'acide sulfurique concentré.
d. Le système prend rapidement une couleur rougéâtre et des vapeurs sont émises. Chauffer pendant 30 min en agitant.
e. Laisser refroidir. Retirer le barreau aimanté car le produit brut passe à l'état solide.
f. Dissoudre le produit en ajoutant progressivement une solution
aqueuse de soude à 1 mol / L en utilisant une agitation magnétique.
g. Placer la solution dans un grand becher.
h. Pour précipiter la fluorescéine, acidifier la solution en ajoutant
progressivement de l'acide sulfurique tout en agitant. Arrêter quand la
phase aqueuse devient limpide.
i. Filtrer sur Büchner.
j. Sécher à l'étuve à 100°C.
On donne l'équation de la réaction de synthèse.
2.1. Identifier les deux réactifs.
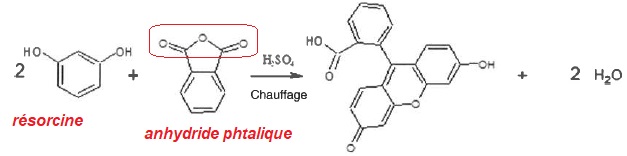
2.2. Montrer que la résorcine est utilisée en excès.
Résorcine : n = m / M(résorcine) = 3,30 / 110 =0,03 mol. ( en excès ).
Anhydride phtalique : n' = m / (M(anhydride phtalique) = 2,00 / 148 =0,0135 mol ( en défaut)
n / 2 = 0,015, valeur supérieure à 0,0135. La résorcine est en excès.
2.3 Sous quel état physique se trouvent les réactifs à la température du bain d'huile ?
Température de fusion : résorcine 110°C ; anhydride phtalique : 131°C.
Les températures d'ébullition de ces réactifs sont voisines de 280°C.
A 180°C, les réactifs sont sous forme liquide.
2.4 Quel est le rôle de l'acide sulfurique de l'étape c ? Justifier.
L'acide sulfurique joue le rôle de catalyseur.
2.5 Quelle est la nature des vapeurs émises lors de l'étape d ? Justifier.
L'eau est l'un des produits de la réaction. A 180°C, l'eau est sous forme de vapeur.
2.6. Sous quelle forme prédomine la fluorescéine à la fin de l'étape f ?
En milieu basique ( pH > 10), la fluorescéine est sous forme Flu2-.
2.7. Pourquoi l'ajout d'acide sulfurique dans l'étape h permet-il la précipitation de la fluorescéine ?
En milieu acide ( pH ~ 3) la fluorescéine est sous forme H2Flu, peu soluble dans l'eau..
2.8. Une masse de 2,47 g de fluorescèine est obtenue. Quel est le rendement de la synthèse ?
M(fluorescéine) =332 g / mol ; nréelle = 2,47 / 332 ~ 7,44 10-3 mol.
nthéorique = n' = 0,0135 mol.
Rendement = 7,44 10-3 / 0,0135 ~0,55 ( 55 %).
|
|
|