Chimie
analytique, Concours interne technicien de la police technique et
scientifique 2017
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
Partie A.
1. De
quoi est composée une essence pour automobile ? Par quel procédé
chimique de séparation est-elle obtenue à partir du pétrole ?
20 à 30 % d'alcanes ( heptane) ; 5 % de cycloalcanes ; 30 à 45 %
d'alcènes ; 30 à 45 % d'hydrocarbures aromatiques de la famille du
benzène.
L'essence est obtenue par distillation fractionnée du pétrole.
2. Citer deux autres techniques de séparation utilisées en chimie analytique.
Centrifugation ; filtration ; décantation ; chromatographie sur colonne.
3
Que signifie "CPG - SM". Donner le principe de cette technique et le
schéma de l'appareillage. En quoi est-elle adaptée à l'analyse de
débris calcinés.
Couplage chromatographie en phase gazeuse et spectrométrie de masse.
La chromatographie est une méthode de
séparation et d'identification des constituants d'un mélange.
La
chromatographie est basée sur la différence de solubilité d'une
substance dans deux phases non miscibles : la phase stationnaire liée
au support et la phase mobile ou solvant.
Plus
une substance est soluble dans la phase mobile, plus elle est entraînée
par cette phase; inversement, une substance peu soluble dans la phase
mobile migre peu.
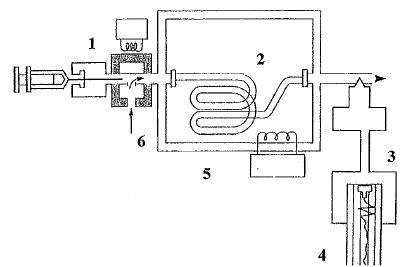
1 : injecteur
; 2 : colonne ; 3 : détecteur ; 4 : intégrateur ou
ordinateur ; 5 : thermostat de colonne ; 6 : gaz vecteur.
La chromatographie permet de séparer les espèces d'un mélange complexe de nature diverses.
4 . Le mode de préparation des échantillons est l'espace de tête statique. Donner cette technique et donner ses limites.
L'échantillon est placé dans un flacon étanche aux gaz. le flacon est
scellé. Les substances volatiles se trouvent dans l'espace de tête,
cela permet de s'affranchir des matrices. Les vapeurs à l'intérieur du
flacon sont prélevées à l'aide d'une seringue. L'échantillon est
injecté dans l'injecteur de la CPG.
On l'utilise pour des concentrations élevées, pour des substances volatiles ; excellente sensibilité, reproductibilité.
L'équilibre dans la phase gazeuse peut être long à atteindre pour des composés peu volatils.
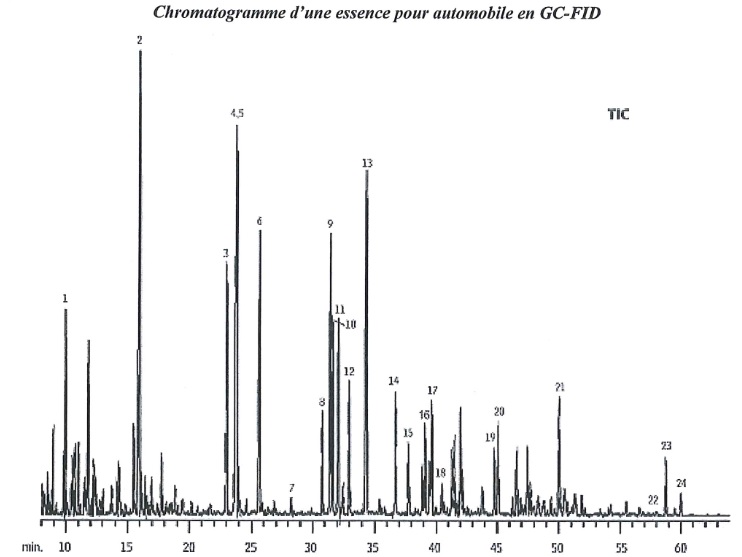
5. Que signifie les termes Rtx- 1,60 m, 0,25 mm ID, 1,00 µm ?.
Rtx : colonne phase aoplaire ( silice fondue ).
ID : diamètre interne 0,25 mm ;. 1,00 µm : épaisseur de couche.
6. Comment s'établit l'ordre d'élution des composés sur le chromatogramme ci-dessus ?
Le pic 2 correspond au toluène, l'une des espèces les moins volatils.
7. Sur quels paramètres peut-on jouer pour améliorer la séparation des pics en CPG ?
On peut jouer sur le temps de rétention : longueur de la colonne, température, débit de la phase mobile.
|
|
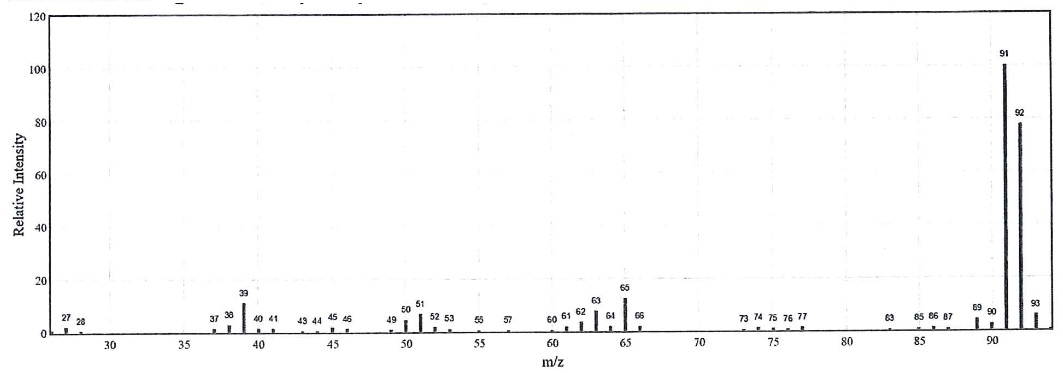
Sur le chromatogramme, le pic 2 possède le spectre de masse suivant. Il s'agit du toluène.
8. Quel est le temps de rétention du toluène ? Donner la formule semi-développée du toluène.
TR (toluène) = 16 min.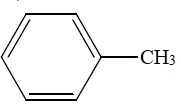
9. Comment peut-on préparer du toluène à partir du benzène ? Donner l'équation chimique de la réction.
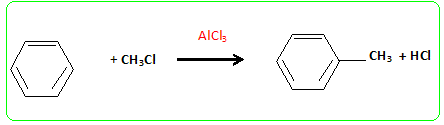
La réaction est une substitution
électrophile du noyau benzénique : alkylation
de Friedel et Craft en présence d'un catalyseur
AlCl3.
10. Identifier le
pic de base, le pic moléculaire sur le spectre de masse. A quelle
espèce peut correspondre le pic de base ? Justifier la présence su pic
à m / z = 93.
Pic moléculaire : m /z = 91.
Pic de base : m / z = 92 correspondant à C7H7+ avec délocalisation de la charge sur le cycle.
La présence du pic à m /z = 93 est dues aux isotopes du carbone ( 13C : 1,08%)
Un des pictogrammes figurant sur les fiches de données de sécurité de l'essence pour l'automobile est :
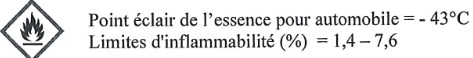
Que signifie ce pictogramme ? Quels sont les risques liés aux caractéristiques physico-chimiques mentionnées ci-dessus ?
L'essence est inflammable même à des températures basses ( -40°C).
En dessous de 1,4 % d'essence il n'y a pas suffisamment de carburant
pour entretenir la combustion ; au dessus de 7,6 % d'essence, il manque
du dioxygène.
Risques : incendie et explosion.
12. A ce stade des recherches, quelle hypothèse peut formuler l'enquêteur quand aux circonstances du décès ?
L'absence de traces de suie dans les bronches écarte l'asphyxie due à la combustion de l'essence.
Circonstances du décès : traces de stangulation sur le cou.
Partie B. Toxicologie.
Les analyses montrent l'absence de monoxyde de carbone et d'acide cyanhydrique dans le sang de la victime.
13. Donner la formule semi-développée et le schéma de Lewis de ces molécules.
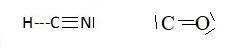
14. Expliquer d'ooù provient le monoxyde de carbone dans un incendie.
Combustion incomplète des matières organiques.
15. Qu'est-ce que
l'intoxycation oxycarbonée ? Ecrire les réactions du mécanisme d'action
du monoxyde de carbone dans le sang (on prendra Hb pour l'hémoglobine).
Intoxication au monoxyde de carbone.
Le
monoxyde de carbone peut se lier à l'ion fer II de l'hémoglobine et
peut prendre la place du dioxygène pour former la carboxyhémoglobine
HbCO, ce que l'on modélise par la réaction d'équation :
HbO2(aq) + CO(g) = HbCO(aq) + O2(g).
Les analyses révèlent la présence de méthamphétamine dans le sang de la victime.
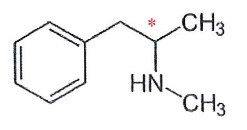
16. La molécule possèdent deux énantiomères R et S. Expliquer
pourquoi. Comment s'appelle un mélange contenant les deux énantiomères
en proportions égales ?
La molécule possède un atome de carbone asymétrique repéré par *.
Un mélange contenant les deux énantiomères en proportions égales est un récémique.
17.
Expliquer le principe et les différentes étapes d'une extraction
liquide-liquide. Quelle autre technique d'extraction pourrait-on
envisager ?
L'extraction consiste à transferer de la façon la plus sélective possible une espèce d'une phase à une autre.
Les solvants ne doivent pas être miscibles.
La substance à extraire doit être très soluble dans l'un des solvants, et peu soluble dans l'autre.
Mise en contact intime des deux liquides durant un temps suffisamment long jusqu'à l'obtention de l'équilibre.
Séparation ultérieure des deux liquides.
Evaporation du solvant.
Autre technique d'extraction : entraînement à la vapeur.
18. A quoi sert la dérivatisation ? Donner la formule développée du TFAA.
C'est une technique qui permet l'analyse de composés qui ne peuvent
être directement analysés en GC. Par réaction chimique avec le produit
à analyser, on synthétise un sous-produit dont les propriétés
facilitent l'analyse par chromatographie.
TFAA : Anhydride trifluoroacétique.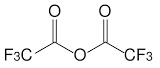
19. Expliquer ce qu'est la méthode HS-SPME ?
Elle permet de réaliser une extraction et une concentration de composés se trouvant à l'état de traces.
Microextraction sur phase solide en mode espace de tête.
La fibre en silice ( sur laquelle est greffé une phase stationnaire
)est plongée dans la solution à analysée ou dans l'espace de tête au
dessus de la solution. les analytes seront progressivement adsorbés par
la fibre.
Un équilibre s'établit entre la phase solide ( fibre) et la phase
gazeuse ou liquide. On retire ensuite la fibre de l'échantillon.
La fibre peut être désorbée en chromatographie en phase gazeuse
La poudre inconnue est identifiée comme étant de l'éphédrine, précurseur de la S-méthamphétamine, selon la synthèse suivante :.
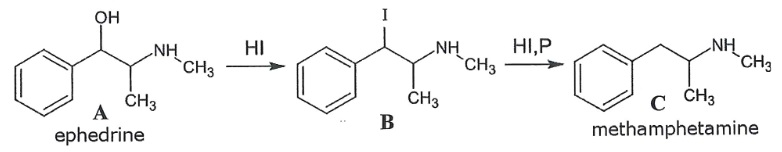
20. Quel est le nom donné au mécanisme qui transforme A en B ? Lors de cette étape un autre produit est formé, lequel ?
Substitution de OH par I. Il se forme également de l'eau H2O.
21. Que signifie ATR ? Décrire son principe.
Réflexion totale atténuée.
Le faisceau optique effectue plusieurs réflexions à l'interfaces entre
l'échantillon et un cristal parallèlépipèdique transparennt en IR et
d'indice de réfraction élevé, supérieur à celui de l'échantillon..
Le faisceau IR initial d'intensité I traverse le cristal, subit une
réflexion totale à l'interface cristal-échantillon ; il est alors
dirigé vers le détecteur. Mais une partie de l'énergie initiale
du faisceau est retenue dans l'échantillon, d'où le mot atténué.
Un détecteur mesure l'intensité de la lumière réfléchie.
C'est une bonne technique pour les échantillons épais ou très absorbants.
|
|
II. Chimie au laboratoire.
Une bouteille porte les indications suivantes : acide sulfurique 900 mL; pourcentage massique en acide 96 % ; r = 1,83 g / mL ; M = 98,08.
1. Que signifie r = 1,83 g / mL ; M = 98,08.
La masse volumique de la solution est égale à 1,83 g / mL ; la masse molaire de l"acide sulfurique est M =98 ,08 g / mol.
2. Calculer r en g / L.
1830 g / L.
3. Vérifier que la masse d'acide sulfurique pur contenu dans la bouteille est m = 1,6 103 g.
m = 1830 *0,900 x0,96 = 1581 ~1,6 103 g.
4. Quelle est la concentration massique Cm de la solution ?
1581 / 0,9= 1,76 103 g/ L.
6. Quelle est la concentration molaire C0 de la solution ?
1,76 103 / 98,08 = 17,9 mol / L.
6. Pour préparer V1 = 1,0 L d'une solution, on utilise un volume V0 = 20 mL de l'acide contenu dans la bouteille. Comment appelle-t-on cette technique et en quoi consiste-t-elle ?
La dilution permet de préparer des solution d'acide sulfurique moins concentrées.
7. Quelle est la grandeur qui se conserve au cours de cette opération ?
La quantiité de matière d'acide sulfurique prélevé se conserve.
8. Calculer la concentration C1 de la solution ainsi réalisée.
Facteur de dilution : 1000 / 20 = 50.
C1 = C0 / 50 = 17,9 / 50 =0,358 ~0,36 mol/ L.
On désire maintenant préparer V2 = 500 mL d'une solution aqueuse de sulfate de sodium Na2SO4 de concentration moalire C2 = 0,200 mol/L.
9. Calculer la masse molaire du sulfate de sodium.
M = 2 x23 +32 +4x16 = 142 g / mol.
10. Calculer la masse m de soluté à peser.
Quantité de matière de sulfate de sodium : V2C2 =0,500 x 0,200 = 0,100 mol.
Masse à peser : 0,100 x142 = 14,2 g.
11. Comment s'appelle cette technique ?
Préparation d'une solution par dissolution d'un solide dans l'eau.
|
|