Physique,
de nouveaux propergols.
Concours général 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
I. Le nitrate d'hydroxylammonium HAN. (NH3OH+, NO3- )
23. Quels avantages présentent les ergols solides ?
Les constituants sont mélangés au sein de la poudre et non pas stockés dans deux réservoirs séparés.
Ils occupent un volume réduit et sont facile à stocker.
Le propulseur à propergol solide est plus simple à concevoir, produit des poussées importantes à moindre coût.
Ils sont rapidement mis en oeuvre : pas de chargement d'rgols avant le lancement.
24.
A quel phénomène peut contribuer la combustion d'un trop fort tonnage de perchlorate d'ammonium ?
Ce genre de combustion peut conduire à une explosion.
25. Quelles propriétés de l'hydrazine peuvent justifier la volonté de son remplacement par d'autres espèces chimiques ?
L'hydrazine est un liquide corrosif, inflammable, toxique, cancèrigène.
26. Citer les deux types d'interactions assurant la cohésion du HAN.
Le HAN est un solide ionique.
Les cations et les anions sont disposés de façon ordonnée. Chaque ion est entouré par des ions de signe opposé.
Chaque ion exerce une focre électrique ( Force de Coulomb) sur les ions voisins de signe opposé.
27. Proposer une explication de la grande solubilité du HAN dans l'eau..
Les nitrates sont solubles dans l'eau.
L'ion hydroxylammonium contient un atome d'oxygène ( deux doublets
libres) pouvant réaliser des liaisons hydrogène avec les molécules
d'eau.
28. Pour un test en laboratoire, le HAN est préparé par réaction acide-base entre l'hydroxylamine NH2OH et l'acide nitrique HNO3.
Une masse m = 30,28 g d'une solution aqueuse d'hydroxylamine à 50 % en
masse est agitée et maintenue à une température infériieure à 4°C à
l'aide d'un bain de glace. L'acide nitrique à 65 % en masse ( r
= 1,40 g /mL) est ajouté goutte à goutte à l'aide d'une burette
graduée. Quel volume d'acide nitrique doit être versé pour réaliser ce
mélange en conditions stoechiométriques. Pourquoi l'addition est-elle
réalisée goutte à goutte et à basse température ?
Quantité de matière d'hydroxylamine = 30,28 x0,5 / M(NH2OH) = 15,14 / 33 = 0,459 mol.
NH2OH + HNO3 --> NH3OH+, NO3- .
Quantité de matière d'acide nitrique : 0,459 mol.
Masse d'acide nitrique dans un litre de solution : 1,4 x0,65 =0,91 kg =910 g.
Concentration de l'acide nitrique : 610 / M(acide nitrique) = 910 / 63 = 14,44 mol / L.
Volume d'acide nitrique : 0,459 / 14,44 ~0,0318 L soit 31,8 mL.
La réaction est exothermique et l'hydroxylamine peut exploser à chaud. D'où l'ajout goutte à goutte et en refroidissant.
II. L'azoture d'ammonium AA.
La fabrication d'un propergol HAN-AA-eau a été étudiée en laboratoire.
29. Quel intérêt l'association des deux propergols HAN et AA présente-t-elle ?
HAN est un oxydant puissant et AA un puissant réducteur.
L'impulsion spécifique du mélange HAN-AA-eau est supérieure à celles des constituants.
30. Quel avantage présente leur forte solubilité dans l'eau ?
Ce sont des ergols hypergoliques qui s'enflamment spontanément lorsqu'ils son en contact.
On les stocke à température ambiante et du fait de leur densité élevée, le volume de stockage est faible.
1. Première méthode de préparation.
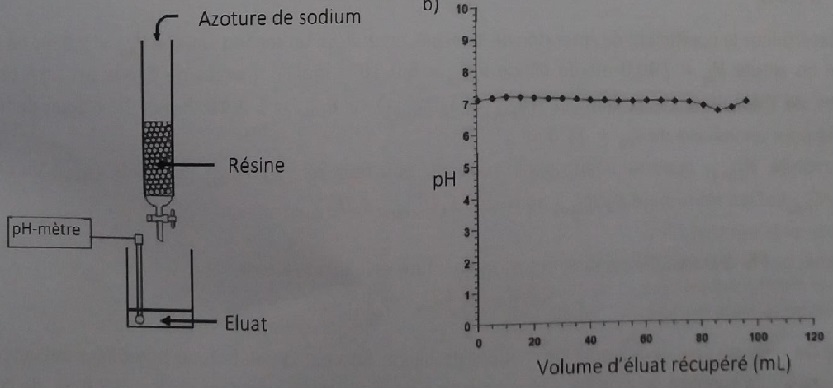
Pour fabriquer une solution d'azoture d'ammonium AA, la première
méthode de préparation fait appel à une colonne de résine échangeuse de
cations. On prépare une colonne de résine, de telle sorte que les
contre-ions mobiles portés par la résine soient des cations ammonium NH4+
et que leur quantité de matière soit très largement supérieure à celle
des cations sodium versés et échangés sur la résine. On rince la résine
avec de l'eau pure jusqu'à ce que le pH de l'éluat soit égal à celui de
l'eau pure. On verse alors très lentement 15,0 mL d'une solution
d'azoture de sodium dans la colonne de la résine et on place un bécher
vide sous la colonne pour y recueillir l'éluat. On laisse s'écouler
lentement la solution jusqu'à ce qu'elle affleure la résine puis on
poursuit par ajout d'eau pure en quantité suffisante. Le pH de l'éluat
est mesuré pendant toute l'élution. La manipulation est réalisée à 25°C.
 31. Ecrire l'équation de la réaction d'échange d'ions qui s'opère sur la résine
31. Ecrire l'équation de la réaction d'échange d'ions qui s'opère sur la résine
Res- NH4+ + Na+(sol) = Res- Na+ + NH4+(sol).
32. Définir la constante d'acidité Ka d'un couple acide base AHaq / A-aq. En déduire le lien entre pH et pKa = - log (Ka).
AHaq + H2O(l) = A-aq + H3O+aq. Ka =[A-aq ] [H3O+aq ] / [AHaq ]
pH = pKa +log([A-aq ] / [AHaq].
33.
On considère un mélange stoechiométrique de deux solutions, l'une
contenant des ions amonium et l'autre des ions azoture. Ecrire
l'équation de la réaction acide base correspondante.
pKa1(NH4+ / NH3)=9,2 ; pKa2(HN3 / N3-)=4,7 ;
NH4+aq + N3-aq = NH3 aq +HN3 aq. K = [NH3 aq] [HN3 aq] / ([NH4+aq][N3-aq]) =Ka1 / Ka2 = 104,7-9,2=3,16 10-5.
34. Déterminer le pH d'une solution issue de ce mélange.
|
avancement volumique (mol/L)
|
NH4+aq |
N3-aq |
= NH3 aq |
+HN3 aq |
initial
|
0
|
c
|
c
|
0
|
0
|
à l'équilibre
|
x
|
c-x
|
c-x
|
x
|
x
|
K = [ x /(c-x)]2 =3,16 10-5 ; x /(c-x) =5,62 10-3.
x ~5,62 10-3 c ; pH ~ - log(5,62 10-3) -log c =2,25-log c.
D'après le graphe ci-dessus, le pH de la solution d'azoture d'ammonium est voisin de 7.
|
|
|
35. Proposer une explication à l'évolution du pH de l'éluat.
En ajoutant de l'eau à une solution ( dilution) acide ou basique, le pH
tendra vers 7. Or le pH initial de l'éluat est déja égal à 7. Par
dilution il ne va pas changer.
36. Peut-on utiliser le pH de l'éluat pour déterminer la fin de l'élution de la solution d'azoture de sodium dans la colonne ?
Non, car le pH reste constant.
37. Proposer une méthode de détermination de la fin de l'élution.
En présence d'ion ammonium, un papier imbibé de sulfate de cuivre anhydre bleuit.
A la fin de l'élution, l''eau distillée ajoutée ne contient pas d'ion ammonium.
Après élution complète, on prélève un volume Va1 = 10,0 mL d'éluat que l'on titre par une solution d'hydroxyde de sodium à cb = 1,00 mol/L
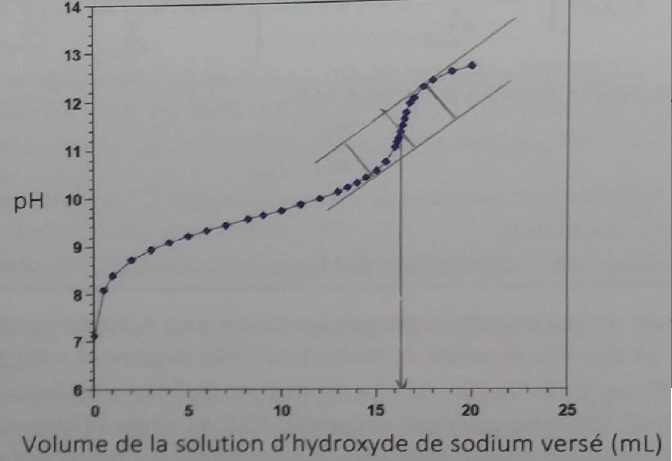
38. Déterminer la quantité de matière n1 d'ion ammonium présents dans 10,0 mL d'éluat.
Volume équivalent : 16,4 mL.
La quantité de matière d'ion ammonium est égale à la quantité de matière d'ion hydroxyde versé à l'équivalence soit 16,4 mmol.
Pour déterminer le coefficient de rétention de la résine, on prélève un second volume Va2 = 2,0 mL de l'éluat auquel on ajoute VI2 = 100,0 mL de diiode à CI2 = 0,050 mol/L. L'excès de diiode est titré par une solution de thiosulfate de sodium ( 2Na+aq +S2O32-aq) à Cthio = 0,50 mol/L. L'équivalence est obtenue pour un volume Véq = 11,0 mL.
2N3-aq +I2aq ---> 3N2aq + 2I-aq avec n(I2 ayant réagi) = ½n(N3-).
39. On note n I2 excès la quantité de matière de diiode titrée par la solution de thiosulfate de sodium et n0 N3- la quantité de matière d'ion azoture présents initialement dans 2,0 mL de l'éluat. Exprimer n I2 excès en fonction de n0 N3- et des données.
VI2 CI2- 0,5n0 N3- = n I2 excès = 5 - 0,5n0 N3- mmol.
40. Ecrire l'équation de la lréaction d'oxydoréduction entre le diiode et l'ion thiosulfate.
I2 aq + 2 S2O32- -aq --> 2I-aq + S4O62-aq.
41. En déduire une autre expression de nI2 excès.
nI2 excès = ½n thiosulfate = Cthio Véq = 0,5 x0,50 x11,0 = 2,75 mmol.
42. Déterminer la quantité de matière d'ion azoture contenus dans 10 mL d'éluat.
5 - 0,5n0 N3- =2,75 ; n0 N3- =(5-2,75) x2 = 4,5 mmol dans 2 mL d'éluat ou 22,5 mmol dans 10 mL d'éluat.
43. En déduire le coefficient de rétention de la résine et commenter.
kr = n(Na+)rés / n(Na+) sol.
n(Na+)rés : quantité de matière d'ion sodium dans la résine après élution ;
n(Na+)sol : quantité de matière d'ion sodium dans la solution avant élution.
n(Na+)sol = n0 N3- =22,5 mmol ; n(Na+)rés =n1 = 16,4 mmol.
kr = 16,4 / 22,5 ~0,73. La résine n'est pas très sélective, l'échange n'est pas total.
|
|
|
|
2. Seconde méthode de préparation.
L'azoture
d'ammonium peut être préparé àl'état solide par barbotage d'une
solution d'ammoniac dans une solution éthérée d'acide hydrazoïque HN3.
Etape 1 : 4,46 g d'azoture de sodium et 25 mL d'eau sont introduits dans un ballon.
Etape2 : on ajoute 25 mL d'éther.
Etape 3 : 5 mL d'acide sulfurique concentré sont ajoutés lentement.
Etape 4 : le mélange réactionnel est chauffé à 40 °C pendant 30
minutes. L'acide hydrazoïque est récupéré dans un erlenmeyer contenant
de l'éther placé dans un bain d'eau glacée.
Etape 5 : une solution aqueuse d'ammoniac est chauffée à l'aide d'un
chauffe-ballon pour créer des vapeurs d'ammoniac que l'on fait barboter
dans l'acide hydrazoïque éthéré placé dans un bain d'eau glacée. Après
filtration et séchage, une masse de 3,21 g de précipité blanc est
obtenue.
45. Ecrire l'équation de la mise en solution de l'azoture de sodium ( étape 1).
NaN3(s) ---> Na+aq +N3-aq.
46. Ecrire l'équation de la réaction correspondant à l'étape 3. Justifier.
Réaction acide base entre un acide fort et une base faible N3-.
H3O+aq + N3-aq ---> HN3aq + H2O(l).
47. Comment se nomme l'opération réalisée à l'étape 4 ?
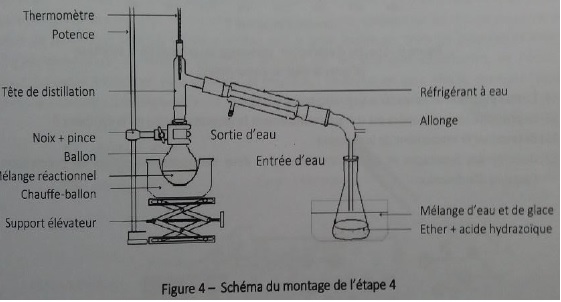
Hydrodistillation : on distille le mélange hétérogène eau + produit ; on récupère un mélange eau + composé organique qui bien souvent surnage.
48. Quel est l'intérêt d'un bain d'eau glacé ?
Les azotures sont très réactifs et instables.
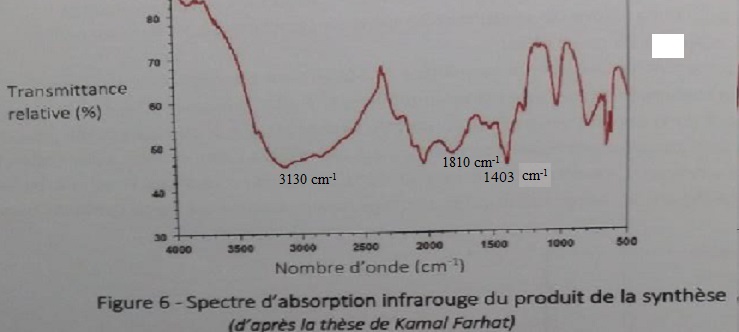
L'analyse spectroscopique dans l'infrarouge du précipité blanc récupéré a été effectuée :
49. Ecrire l'équation de la réaction se produisant à l'étape 5.
NH3 + HN3 ---> (NH4+, N3-)solide.
50. Le précipité blanc récupéré est-il vraisemblablement le produit attendu de la synthèse ? Oui
Table réduite des nombre d'onde en IR de l'ion ammonium dans l'azoture d'ammonium : 1403 ; 1810 ; 2846 ; 3130 cm-1.
51. Déterminer le rendement de la synthèse.
Quantité de matière d'azoture de sodium (M=65 g/mol) : 4,46 / 65 ~ 0,0686 mol.
Quantité de matière théorique d'azoture d'ammonium : 0,0686 mol.
Quantité de matière réelle d'azoture d'ammonium (M=60 g/mol) : 3,21 / 60 ~0,0535 mol
Rendement : 0,0535 / 0,0686 ~0,78 ( 78 %).
52. Discuter des avantages et des inconvénients des deux méthodes présentées.
La méthode utilisant la résine est plus facile à mettre en oeuvre, mais le produit n'est pas pur.
|
|
|