Don du sang ;
dosage du diiode ; l'aspartame , Bac ST2S Polynésie 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
Lors d’une collecte au sein de son
université, une étudiante décide d’effecteur un don de sang. Elle suit
un parcours en quatre étapes : l’accueil, l’entretien préalable au don,
le prélèvement, le repos/collation.
Profil de l'étudiante : Âge : 19 ans ; Taille : 1,65 m : Masse
corporelle : 65 kg : Volume sanguin total estimé : 4,5 L
1. Conditions initiales et
tension artérielle.
1.1. Justifier que
l’étudiante remplit les conditions physiques initiales pour pouvoir
effectuer un don de sang.
Le don possible pour toute personne âgée de 18 à 70 ans, mesurant plus
de 1,36 m et pesant plus de 50 kg.
1.2. Lors de
l’entretien préalable au don, le médecin mesure une pression artérielle
systolique de 117 300 Pa juste au-dessus du coude de la patiente
assise, son bras étant le long du corps.
1.2.1. Justifier le
fait que la mesure de la pression artérielle soit réalisée juste
au-dessus du coude.
Le coeur se trouve à la même altitude que le dessus du coude d'une
personne assise.
1.2.2. Exprimer la
tension artérielle T en fonction de la pression artérielle p et de la
pression atmosphérique patm.
T = p -patm.
1.2.3. Montrer que
la tension artérielle T vaut 16 000 Pa.
T = 117 300-101 300 = 16 000 Pa.
1.2.4. Justifier
que la tension systolique de l’étudiante convient à un don de sang.
La tension artérielle systolique T dit être comprise entre : 10 cm Hg
< T < 18 cm Hg.
1 cm Hg = 1333 Pa.
Pression systolique de l'étudiante :1 cm Hg = 1 333 Pa.
Pression systolique - pression atmosphérique =
16 000 / 1 333 ~ 12 cm Hg, valeur appartenant à l'intervalle [10 ; 18
cm Hg ]
2. Température corporelle.
L’étudiante a été malade une vingtaine de jours avant le don.
Le médecin qui réalise l’entretien préalable mesure sa température
corporelle à l’aide d’un thermomètre auriculaire.
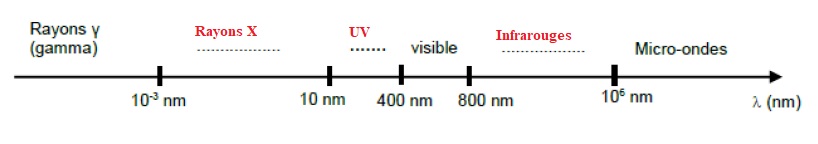
2.1.Compléter le
diagramme des longueurs d’onde dans le vide par le nom des différents
domaines, en utilisant les mots : « rayons X, infrarouge, ultraviolet»
2.2. Le thermomètre
auriculaire enregistre une onde d’intensité maximale de fréquence f =
3,10×1013 Hz.
Montrer que la longueur d’onde λ dans le vide correspondant à cette
onde vaut 9,68 ×10-6 m.
l = c
/ f = 3,00 108 /(3,10×1013) ~ 9,68 ×10-6
m~ 968 nm.
2.3. Justifier que le thermomètre
auriculaire est sensible à cette onde.
On rappelle que 1 nm = 10-9 m.
Un thermomètre auriculaire contient un récepteur sensible au
rayonnement infrarouge émis par le tympan et le tissu environnant. Il
permet de déterminer la température du corps émettant ces ondes.
Une onde de longueur d'onde dans le vide égale à 968 nm
appartient au domaine infrarouge.
3. Volume de sang prélevé
et durée du prélèvement.
3.1. Déterminer le
volume maximal Vmax de sang qui pourrait être prélevé lors
du don de sang de l’étudiante.
Volume de sang prélevé : inférieur à 13 % du volume sanguin total
estimé à 4500 mL.
0,13 x4500 = 585 mL.
Par mesure de précaution, pour cette étudiante, le volume V prélevé
sera de 480 mL.
Le débit volumique moyen D du système de prélèvement est estimé à D =
7,5×10-4 L·s-1.
3.2. Exprimer la
relation entre le débit volumique D, le volume V et le temps t et
indiquer les unités de chacune des grandeurs lorsque D est exprimé en
L·s-1.
D = V / t aved D en L s-1, V en L et t en seconde.
3.3. Montrer que la
durée de prélèvement du sang est d’environ 10 minutes.
t = V / D = 0,480 / (7,5 10-4)
= 640 s soit 10 min 40 s.
|
|
|
|
|
Exercice II : Utilisation d’un antiseptique
durant le prélèvement .
Avant de réaliser le prélèvement de sang, l’infirmier en charge de cet
acte procède à la neutralisation de micro-organismes potentiellement
présents sur la peau de l’étudiante au niveau de l’intérieur du coude.
Pour cela, il peut utiliser une solution antiseptique de Bétadine.
On désire vérifier la teneur en diiode d’une solution de Bétadine
commerciale à 10 %.
1. Dilution de la
solution commerciale.
La solution de Bétadine étant trop concentrée pour être dosée
directement, il convient de la diluer au 1/20, c’est-à-dire de la
diluer 20 fois.
Cocher le matériel de laboratoire nécessaire à la réalisation de la
solution de Bétadine diluée parmi la liste proposée.
Le volume de la fiole jaugée doit être égal à 20 fois le volume de la
pipette jaugée.

2. Dosage du diiode
I2 contenu dans la solution de Bétadine diluée.
Le dosage d’une solution a pour but de déterminer sa concentration
molaire.
On dose un volume V1 = 10,0 mL de solution diluée de
Bétadine de concentration C1 par des ions thiosulfate S2O32-
contenus dans une solution de thiosulfate de sodium
de concentration C2 = 3,0×10-3 mol·L-1.
On ajoute quelques gouttes d’empois d’amidon à la solution diluée de
Bétadine.
L’empois d’amidon donne une coloration bleue en présence de diiode.
Lors de ce dosage, les couples rédox mis en jeu sont :
I2 / I- dont la demi-équation correspondante est
: I2
+2e- =2 I-.
S4O62- /S2O32- dont la
demi-équation correspondante est : S4O62- + 2e-
= 2S2O32- .
2.1. Indiquer les
formules chimiques et la nature (oxydant ou réducteur) des réactifs mis
en jeu dans la réaction chimique de ce dosage.
S2O32- est le
réducteur et le diode est l'oxydant.
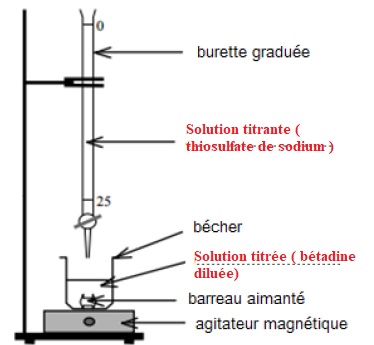
2.2. Annoter le schéma de montage du
dosage.
2.3. En utilisant
les demi-équations relatives aux couples rédox mis en jeu, montrer que
l’équation de dosage est : I2 + 2 S2O32- ---> 2 I-
+ S4O62-.
2S2O32- = S4O62- + 2e-
;
I2
+2e- =2 I-.
Ajouter et simplifier :
I2
+ 2 S2O32- ---> 2 I-
+ S4O62-.
2.4. Donner deux adjectifs
qualifiant une réaction chimique de dosage.
Réaction rapide et totale.
2.5. Lors du
dosage, la solution initialement colorée en bleue devient incolore.
Indiquer le nom de ce point particulier du dosage et justifier le
changement de couleur.
L'équivalence.
2.6. La
décoloration totale de la solution bleue est observée pour un volume VE
= 13,4 mL.
2.6.1. Montrer que
: C1 = C2 ×VE/ (2×V1).
Quantité de matière de diiode : ndiiode = V1 C1.
Quantité de
matière d'ion thiosulfate : nthio = VE C2.
D'après les nombres stoechiométriques de l'équation : nthio =2ndiiode
:
VE
C2 = 2V1
C1 ; C1
= C2 ×VE/ (2×V1).
2.6.2. Calculer la valeur de la
concentration C1 de la solution de Bétadine diluée.
13,4 x 3,0 10-3 / (2 x10,0)= 2,0 10-3 mol/ L.
3. Vérification du
titre de la Bétadine commerciale.
3.1. Déduire, de la
question 2.6.2, la concentration C de la solution commerciale de
Bétadine.
2,0 10-3 x20 = 4,0 10-2 mol/ L.
3.2. Montrer que la
quantité de matière n de diiode présent dans V = 100 mL de solution de
Bétadine est n = 4,0×10-3 mol.
4,0 10-2 *0,1 = 4,0 10-3 mol.
3.3. Déterminer la
masse m de diiode présent dans V = 100 mL de solution en considérant
que la masse molaire moléculaire M du diiode dans la Bétadine vaut M =
2 344 g·mol-1. La valeur importante de cette masse molaire
moléculaire s’explique par le fait que le diiode est emprisonné dans
une macromolécule.
m = 4,0 10-3 x2344 = 9,376 ~9,4 g.
3.4. Comparer la
valeur obtenue à celle indiquée sur l’étiquette du flacon de Bétadine (
10 g de diiode pour 100 mL de solution).
Ecart relatif ( 10-9,4) / 10 x 100 = 6 %.
|
|
Repos
et collation après le don (7 points)
Après un don de sang, il est important de bien s’hydrater et de se
reposer pendant une vingtaine de minutes, durant lesquelles une
collation est offerte.
L’étudiante choisit une boisson aromatisée à la fraise contenant un
édulcorant, l’aspartame.
1. La molécule
d’aspartame
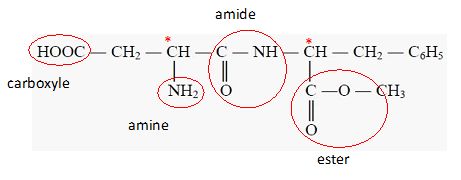
Entourer et identifier les fonctions amide, amine, ester et acide
carboxylique, présentes dans la molécule d’aspartame.
 2. Hydrolyse de l’aspartame
2. Hydrolyse de l’aspartame
Dans l’estomac, milieu acide, l’aspartame subit une transformation
chimique appelée « hydrolyse ». Il se forme alors trois espèces
chimiques : la phénylalanine, l’acide aspartique, le méthanol.
2.1. Justifier le
fait que la molécule d’acide aspartique est un acide alpha-aminé.
La molécule d'acide aspartique possède une fonction amine et une
fonction acide carboxylique portées par le même carbone.
2.2. Recopier la
formule semi-développée de la molécule d’acide aspartique et repérer,
par un astérisque (*), l’atome de carbone asymétrique.
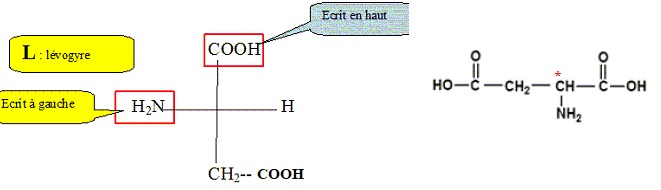
2.3. Donner la
représentation de Fischer du L-acide aspartique.
2.4. Indiquer la
formule semi-développée de la molécule de méthanol.
CH3--OH.
3.1. Écrire la
formule brute de la molécule d’aspartame à partir de sa formule
semi-développée .
3.2. Vérifier que
la masse molaire moléculaire de l’aspartame vaut M = 294,0 g·mol-1.
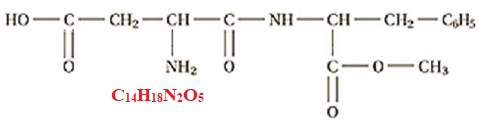
M = 14 x12 +18 +2 x14 +5 x16 = 294 g / mol.
3.3. Compte-tenu de la masse de
l’étudiante ( 65 kg) , déterminer la masse maximale mmax
d’aspartame qu’elle peut consommer par jour.
Dose journalière admissible (DJA) de l’aspartame : 40 mg·kg-1.
mmax = 65 x40 = 2600 mg = 2,6 g.
3.4. La boisson choisie par
l’étudiante contient 60 mg d’aspartame par litre. Si cette boisson est
la seule source d’aspartame dans l’alimentation de l’étudiante.
Déterminer le volume maximal Vmax de boisson qu’elle peut
ingérer.
Vmax = 2600 / 60 = 43,3 L.
3.5. L’étudiante risque-t-elle de
dépasser la DJA ?
L'étudiante ne risque pas de dépasser la DJA.
L’arôme de fraise peut
être synthétisé en laboratoire en réalisant une estérification au moyen
d’un chauffage à reflux.
4.1. Parmi les
montages proposés ci-dessous, indiquer celui qui correspond au
chauffage à reflux.
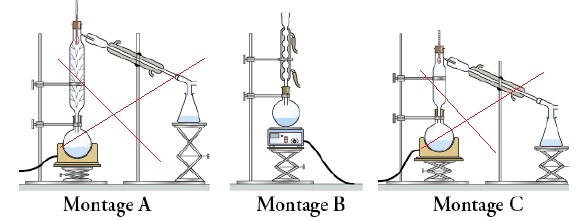
4.2. Expliquer pourquoi « le
chauffage à reflux » est choisi pour réaliser cette estérification.
L'estérification est
lente. Le chauffage à reflux permet d'accélérer la réaction en évitant
les petes de matière ( les vapeurs se condensent dans le réfrigérant et
retombent dans le milieu réactionnel).
4.3. La réaction d’estérification
s’écrit :
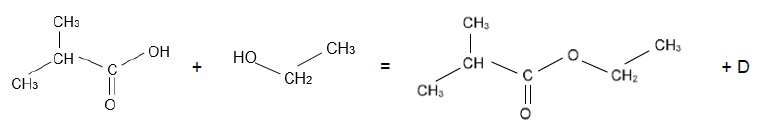
Donner le nom et la
formule chimique de la molécule D.
D est une molécule d'eau H2O.
|
|