Prise orale de
médicaments et absorption des principes actifs.
Concours général 2017.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
A.1 Lieux d'absorption des médicaments.
La
prise de médicaments par voie orale est la plus naturelle et la voie la
mieux acceptée par les patients. C'est d'ailleurs la voie la plus
utilisée en dehors du milieu hospitalier. Le principe actif doit alors
passer de l’intérieur du tube digestif vers la circulation sanguine.
1. La très grande majorité des médicaments passe dans le sang au niveau de l’intestin. Justifier cette affirmation.
La surface d'absorption est très grande et l'intestin est très vascularisé.
2. Citer un inconvénient de l’absorption intestinale.
Le temps de passage d'une espèce ingérée est d'environ 8 heures.
La trinitrine (ou trinitrate de glycérol) est utilisée pour soulager
les douleurs lors d’une crise d’angine de poitrine. Elle est
généralement éliminée après biotransformation hépatique, avec un
important effet de premier passage hépatique. Le foie contient des
réductases très actives qui vont supprimer les groupes nitrates (-ONO2) pour aboutir à un composé inactif.
3. Pour une action immédiate (soulagement de la douleur 3 min après la prise), décrire le mode
d’administration de la trinitrine. Justifier.
La face inférieure de la langue est tapissée par une muqueuse très mince et fortement
vascularisée. Le temps de passage d'une espèce ingérée est de 2 à 10 s.
Les principes actifs absorbés au niveau buccal passent dans le sang qui parvient directement
dans la veine cave supérieure et est acheminé directement vers le coeur pour être distribué au
travers de l'organisme une première fois avant de passer par le foie.
L'effet de premier passage dans le foie est très important. La durée
nécessaire pour que la moitié des molécules présentes dans le sang
soient inactivées ou éliminées est de 1 à 3 min.
A.2. Mode de transport des principes actifs.
Pour passer de l’intérieur du tube digestif vers la circulation
sanguine, les principes actifs doivent franchir une paroi composée
d’une bicouche lipidique.
4. Identifier les critères qui permettent une diffusion passive rapide à travers la paroi.
Les molécules traversent la paroi de manière spontanée. La vitesse de
passage ou le nombre de particules qui traverse la paroi par unité de
temps obéit à la loi de Fick :
V=D×S× (Ce-Ci) / a
D : coefficient de diffusion de la molécule à travers la paroi (plus la
molécule est soluble dans la paroi, plus la valeur de D est élevée).
S : surface de la paroi.
Ce : concentration de la molécule à l’intérieur du tube digestif.
Ci : concentration de la molécule dans le sang.
a : épaisseur de la paroi.
La surface et l'épaisseur de la paroi sont fixées.
La molécule doit être très soluble dans la paroi, D élevé.
La concentration de la molécule à l’intérieur du tube digestif doit être très supérieure à sa concentration dans le sang.
5. Identifier le caractère hydrophile ou lipophile de la paroi du tube digestif (bicouche lipidique). Un
raisonnement sur la structure chimique des phospholipides est attendu.
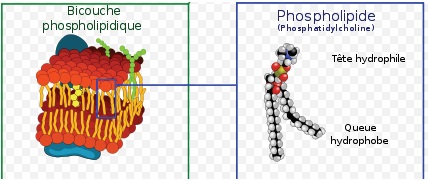
La
partie extérieure de la paroi contient la tête hydrophile du
phospholipide, alors que l'intérieur contient la queue hydrophobe des
phospholipides. La paroi externe est hydrophile, l'intérieur est
hydrophobe.
6. Expliquer
pourquoi l’absence de transporteurs ne permettrait pas l’absorption des
acides α aminés et des sucres à travers la paroi du tube digestif.
La membrane est imperméable aux molécules hydrophiles ( acide a aminés et sucres).
Le Valaciclovir, principe actif de médicaments utilisés dans le traitement des zonas et herpès, est
représenté ci-dessous ; il est obtenu par réaction d’estérification entre une première molécule qui
possède les propriétés biologiques recherchées et une seconde molécule
qui assure le transport au travers de la bicouche lipidique.
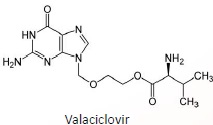
Informations complémentaires :
Equation de la réaction d’estérification :
R—CO2H + R’OH = R—CO2—R’ + H2O
Priorité des groupes fonctionnels en nomenclature :
- acide carboxylique > dérivés d’acide > composés carbonylés > alcools et amines ;
- le groupe NH2 est appelé groupe amino lorsqu’il n’est pas prioritaire.
7. Écrire la formule semi-développée de la molécule qui possède les propriétés biologiques recherchées.
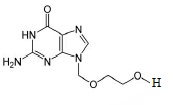
8. Identifier et nommer la molécule qui assure le transport à travers la paroi.
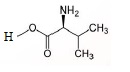
Acide 2-amino-3-méthylbutanoïque.
|
|
|
A.3. Influence de la lipophilie du principe actif.
La lipophilie d’une molécule peut être mesurée in vitro en déterminant
la valeur du coefficient de partage de cette molécule entre les deux
phases d’un mélange constitué d’un solvant aqueux et d’un
solvantorganique (l’octan-1-ol de masse volumique ρ = 824 kg.m-3). L’équation de la réaction de partage de PA (molécule de principe actif) entre les deux solvants est écrite ci-dessous :
P.A. (aq) = P.A. (octan-1-ol) (R1)
9. Expliquer
pourquoi un mélange d’eau et d’octan-1-ol est constitué de deux phases.
Représenter, lors de l’étape de partage entre les deux solvants,
l’ampoule à décanter avec les solvants et les différentes fractions de
principe actif PA.
L'eau est un solvant polaire ; l'octan-1-ol possèdant unne longue
chaîne carbonée hydrophobe est très peu soluble dans l'eau. Dans
l'ampoule à décanter, le solvant le plus dense ( l'eau) occupe la
partie inférieure. L'eau contient P.A(aq). L'octan-1ol occupe la partie
supérieure et contient P.A ( octan-1-ol).
10. Donner l’expression du quotient de réaction Qr de la réaction (R1). Indiquer la relation à l’équilibre entre le quotient de réaction Qr et la constante d’équilibre K de cette réaction, constante appelée coefficient de partage.
Qr = [P.A(octan-1-ol)] / [P.A (aq)].
A l'équilibre Qr(éq) = K.
11. Proposer une méthode expérimentale pour déterminer la valeur de la constante de partage.
Dans une ampoule à décanter, réaliser l'extraction de P.A(aq) par une solution d'octan-1-ol.
Procéder ensuite au titrage de P..A(aq) encore présent dans la solution aqueuse.
12. Une molécule lipophile possède-t-elle un coefficient de partage élevé ou faible ? Justifier la réponse.
Une molécule lipophile est plus soluble dans l'octan-1-ol que dans l'eau. A l'équilibre, [P.A(octan-1-ol)] >> [P.A (aq)] et en conséquence le coefficient de partage est grand.
13. Parmi les deux principes actifs donnés ci-dessous, identifier celui qui possède la lipophilie la plus grande. Justifier.
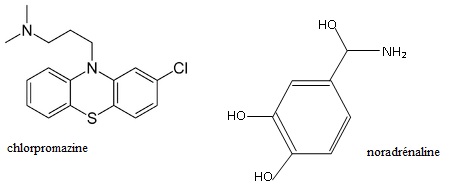
La noradrénaline est polaire ( présence de groupes OH et NH2). Elle est plus soluble dans l'eau que dans l'octan-1-ol. Elle possède la lipophilie la plus faible.
14. Ces deux
principes actifs sont administrés simultanément. En faisant l’hypothèse
d’une diffusion passive, relier chaque molécule aux courbes données
ci-dessous, en justifiant la réponse.
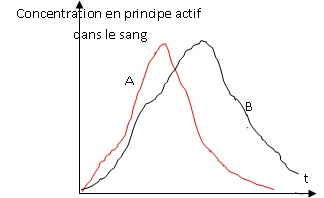
La noradrénaline est la molécule la plus polaire.
La membrane est imperméable aux molécules hydrophiles. Plus
la
molécule est soluble dans la paroi, plus la valeur du coefficient de
diffusion D est élevée). La courbe B correspond à la noradrénaline.
|
|
|
|
A.4. Effet du pH sur la capacité d’absorption du principe actif.
Le pH du tube intestinal et le pH du sang sont des facteurs qui peuvent influencer la capacité d’absorption d’un principe actif.
15. À l’aide des
informations fournies ci-dessous, montrer, en justifiant le
raisonnement quantitatif suivi, que le pH du sang a une valeur proche
des valeurs normales au niveau des alvéoles pulmonaires.
Le dioxyde de carbone dans le sang :
Dans ce document, le sang peut être assimilé à une solution aqueuse. Le sang transporte du dioxyde de carbone dissous CO2(aq). En effet, le dioxyde de carbone gazeux est produit par les différents organes et transporté par le sang vers les poumons.
Le dioxyde de carbone dissous dans le sang réagit avec l’eau suivant la réaction acido-basique (R2) :
CO2 (aq) + 2 H2O = H3O+aq+ HCO3-(aq) (R2)
Cette réaction est caractérisée par la constante d’acidité Ka1 du couple acido-basique CO2(aq),H2O/ HCO3-(aq) dont l’expression à l’équilibre est la suivante : Ka1 = [H3O+aq][HCO3-(aq)] / [CO2(aq),H2O]= 4,27 x 10-7 à 25°C.
Loi de Henry.
Lorsqu’un gaz est en contact avec une solution aqueuse, une partie de
ce gaz se dissout en solution. La concentration molaire en gaz dissous
est proportionnelle à la pression du gaz au contact de la solution.
Dans le cas du dioxyde de carbone CO2, le coefficient de proportionnalité vaut :
KCO2 = 3,35 x 10-2 mol.L-1.bar-1 à 25°C.
|
pH du sang
|
pH de l'urine
|
Pression de CO2
dans les alvéoles pulmonaires
|
Concentration
HCO3-
|
Pression de O2
dans les alvéoles pulmonaires |
Valeurs normales
|
7,25 - 7,45
|
6 - 7
|
40 mm Hg
|
22 - 26 mmol /L
|
100 mm Hg
|
Une pression de 1 bar équivaut à une pression de 760 mmHg ou de 1x105 Pa.
[CO2(aq),H2O]=3,35 x 10-2 x 40 / 760 =1,76 10-3 mol/L.
[HCO3-(aq)] ~2,4 10-2 mol/L.
[H3O+aq] =Ka1 [CO2(aq),H2O] / [HCO3-(aq)]=4,27 x 10-7 x 1,76 10-3 / (2,4 10-2)=3,13 10-8 mol/L.
pH = -log(3,13 10-8) ~7,5.
16. L’ion hydrogénocarbonate HCO3-
formé par la réaction (R2) peut réagir à son tour avec l’eau en
libérant un ion hydrogène. Donner, à l’équilibre, l’expression de la
constante d’acidité Ka2 associée à cette réaction qui a pour valeur 4,79x10-11 à 25°C. Que peut-on attribuer comme qualificatif à l’ion hydrogénocarbonate ?
HCO3-(aq) +H2O =CO32-aq +H3O+aq. Ka2 =[CO32-aq][H3O+aq] /[HCO3-(aq)].
HCO3-peut se comporter comme un acide ou comme une base. Il est amphotère.
17. Tracer le diagramme de prédominance des espèces acido-basiques issues de CO2(aq) en fonction du pH. En déduire l’espèce prédominante dans le sang.
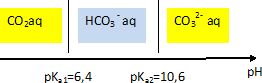
A pH 7,5, HCO3-(aq) prédomine.
L’acide acétylsalicylique, principe actif de l’aspirine, est un acide faible de pKa=3 et dont la formule topologique est représentée ci-contre.
18. Ecrire la formule de Lewis de sa base conjuguée.
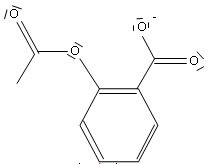
19. Expliquer pourquoi seule la forme acide de l’aspirine peut traverser la paroi du tube digestif pour être absorbée dans le sang.
La forme acide de l'aspirine est moins polaire que sa forme basique.
La membrane du tube digestif est imperméable aux molécules hydrophiles.
20. Montrer qu’il y
a de l’ordre de 100 000 fois plus de forme basique que de forme acide
du principe actif de l’aspirine dans l’intestin.
pH de l'intestin : ~7,5.
pH = pKa + log ( [A-] / [AH]) ; 7,5 = 3 +log ( [A-] / [AH] ; log ( [A-] / [AH] ) ~4,5 ; [A-] / [AH] ~104,5.
21. L’aspirine pH =
8 est encapsulée dans une membrane résistante au milieu acide et se
délitant dans un milieu basique ; elle peut ainsi être libérée au
niveau de l’intestin. Sur la notice, il est indiqué de ne surtout pas
croquer le comprimé. Justifier cette consigne.
Le fait de croquer, détruit l'enrobage gastrorésistant. Le pH de
l'estomac est compris entre 2 et 3. La forme AH de l'aspirine
majoritaire dans l'estomac, est libérée dans le sang au niveau de
l'etomac.
22. En raisonnant sur l’équilibre acido-basique, justifier pourquoi l’aspirine pH = 8 est tout de même absorbée dans le sang.
Espèces majoritaires dans l'intestin : HCO3- (acide) et A-, base conjuguée de l'aspirine.
HCO3- aq +A- aq = AHaq +CO32-aq.
AH ultraminoritaire traverse la paroi de l'intestin et se
retrouve dans le sang. Pour compenser cette disparition, l'équilibre
est déplacé progressivement vers la droite.
23. En utilisant la loi de Fick (partie A.2) expliquer pourquoi on parle alors d’aspirine à action prolongée.
La forme A- de l'aspirine est hydrophile ; la paroi de l'intestin est hydrophobe. Le coefficient de diffusion D est faible, l'espèce A- étant peu soluble dans cette paroi.
|
|
|
|