Contrôle de
qualité d'un vin.
BTS Bioanalyses et controles 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
La casse ferrique.
Le
vin contient en faible quantité des ions fer (II) et fer(III). Lors des
différentes manipulations du vin, la dissolution du dioxygène de l'air
dans le vin entraîne une oxydation partielle des ions Fe2+ en ion Fe3+. Si la concentration en ion Fe3+ est trop importante, ces ions précipitent avec les ions phosphate PO43- présents
dans le vin. Le trouble blanc obtenu, appelé casse ferrique, rend
impossible la commercialisation du vin. Un vin présente un risque de
casse ferrique lorsque la teneur en élément fer dépasse 10 mg/L.
Il est donc nécessaire de déterminer la concentration totale en élément
fer dans un vin. On se propose de contrôler la qualité d'un vin blanc.
Dosage par étalonnage.
1ère étape.
Il faut que tout le fer soit sous forme d'ions fer(III). Pour cela, on
ajoute sur l'échantillon de vin analysé, en milieu acide, du peroxyde
d'hydrogène H2O2 en escès pour oxyder les ions fer (II) en ion fer(III). L'équation de la réaction est :
2Fe2+aq + H2O2aq + 2H+aq ---> 2Fe3+aq + H2O(l).
Indiquer l'intérêt de l'utilisation du peroxyde d'hydrogène comme oxydant.
Le peroxyde d'hydrogène est un oxydant puissant et les seuls produits de la réction sont les ions fer(III) et l'eau.
2ème étape. complexation des ions fer(III) par les ions thiocyanate.
On verse ensuite une solution de thiocyanate de potassium (K+aq + SCN-aq). Les ions SCN- forment avec les ions Fe3+ obtenus lors de la première étape un complexe rouge sang. Ce complexe est l'ion thiocyanato fer(III) de formule :[Fe(SCN)]2+.
L'équation de la réaction de formation de ce complexe s'écrit :
Fe3+ aq + SCN-aq = Fe(SCN)]2+aq.
Sa constante d'équilibre vaut K = 1,3 102.
Expliquer la nécessité d'introduire les ions thiocyanate en excès.
K n'est pas rès élevée et la réaction conduit à un équilibre.
En ajoutant des ions thiocyanate en excès, l'équilibre est déplacé dans le sens direct.
3ème étape. Dosage spectrophotométrique de l'élément fer dans le vin.
On a préparé une gamme de solutions étalons de complexe Fe(SCN)]2+aq. Pour chacune d'elles, on mesure l'absorbance A à une longueur d'onde l judicieusement choisie.
On donne la courbe représentant l'évolution de l'absorbance A en fonction de la concentration C.
|
|
|
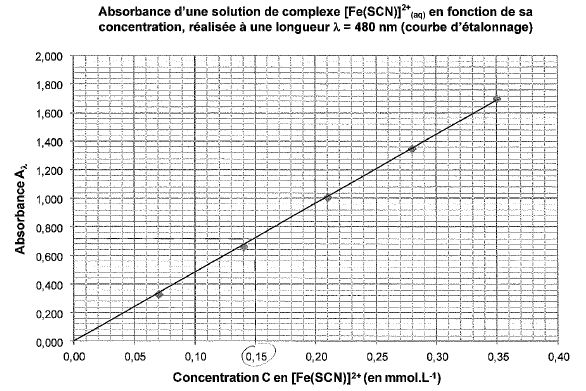
3.1 Montrer que la courbe est en accord avec la loi de Beer-Lambert.
La courbe est une droite passant par l'origine. La concentration et
l'absorbance sont proportionnelles. Donc accord avec cette loi.
Le coefficient de proportionnalité vaut :
1,68 / 0,35 = 4,8 L mmol-1.
|
|
|
|
A l'aide du spectre d'absorption de l'ion complexe Fe(SCN)]2+donné ci-dessous, expliquer le choix de la longueur d'onde l = 480 nm utilisée pour ce dosage.
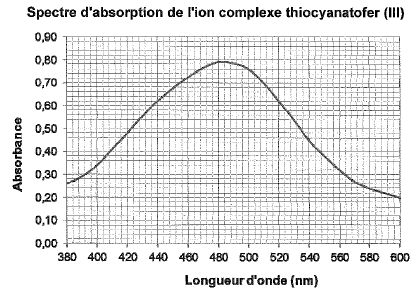
Pour une meilleur sensibilié, on se place au maximum d'absorption de la
solution. Les valeurs de l'absorbance sont plus précises et
exploitables.
Dans un tube à essais, on verse 5,0 mL de vin blanc analysé, 1,5 mL
d'acide chlorhydrique, 2,0 mL de peroxyde d'hydrogène et enfin 1,5 mL
d'une solution de thiocyanate de potassium pour un volume total de 10
mL. On note Svin la solution rouge obtenue à partir de ce vin blanc.
Dans les mêmes conditions de mesures, l'absorbance de cette solution est ASvin = 0,720.
3.3. Déterminer graphiquement la concentration molaire Cs en complexe. En déduire la concentration molaire en élément fer dans la solution Svin.
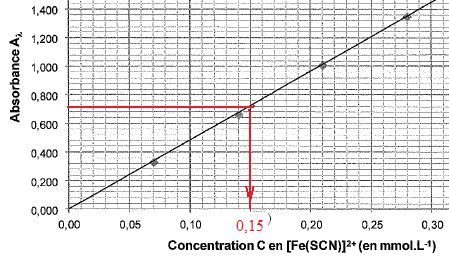
[Fe3+]Svin = Cs = 0,15 mmol/L.
3.4. Montrer que la concentration molaire C0 en élément fer dans ce vin est 0,30 mmol / L.
Il faut prendre en compte le facteur de dilution : 5 mL de vin on été dilué deux fois afin d'obtenir 10 mL de solution Svin.
C0 = 2 Cs = 0,30 mmol/L.
3.5. Calculer la concentration massique Cm0 en élément fer dans ce vin et conclure. M(Fe) = 55,8 g/ mol.
Cm0 = M(Fe)C0 = 0,30 *55,8 ~16,7 mg / L.
Cette valeur étant supérieure à 10 mg / L, ce vin présente un risque de casse ferrique.
|
|