Triglycérides,
titrage acide base, pression.
Bac St2S Métropole 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Exercice
1 : IRC et risque cardio-vasculaire.
Les personnes qui souffrent d’une IRC peuvent présenter une
hyper-triglycéridémie, c'est-à-dire un excès de triglycérides dans le
sang. Il est donc conseillé aux patients qui présentent ces troubles de
limiter l’apport de graisses dans leur alimentation. Ils doivent de
plus privilégier celles qui proviennent d’acides gras insaturés.
1. Définir le terme
« triglycéride ».
Un triglycéride est un triester du glycérol et d'acides gras.
2. L’huile d’olive
contient un triglycéride appelé oléine dont la formule semi-développée
est la suivante :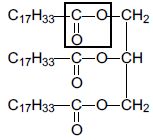 Donner le nom du groupe
caractéristique encadré dans la formule semi-développée précédente.
Donner le nom du groupe
caractéristique encadré dans la formule semi-développée précédente.
Il s'agit du groupe ester.
3. On peut
synthétiser l’oléine à partir du glycérol et de l’acide oléique.
L’équation bilan de la réaction est la suivante :
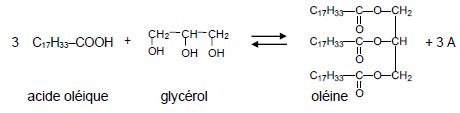
3.1. Indiquer le
nom du composé A figurant dans l’équation bilan précédente.
eau H2O.
3.2. Donner le nom
du glycérol en nomenclature officielle.
propan1, 2, 3-triol.
3.4. Envisager si
un patient qui souffre d’IRC peut privilégier l’utilisation d’huile
d’olive pour la préparation de ses repas. Justifier la réponse en
utilisant la question précédente.
Oui, le patient doit limiter
l’apport de graisses dans leur alimentation. Il doit de plus
privilégier celles qui proviennent d’acides gras insaturés.
3.5. On fait réagir une quantité
d’acide oléique n1 égale à 0,126 mol avec du glycérol en
excès. À l’aide de l’équation bilan donnée ci-dessus, montrer que la
quantité d’oléine n2 attendue est égale à 0,042 mol. Cette
quantité correspond environ aux trois cuillers à soupe d’huile d’olive
recommandées pour la consommation quotidienne.
A partir de 3 moles d'acide oléique on obtient une mole de triglycéride
( oléine).
A partir de 0,126 mole d'acide oléique on
obtient 0,126 /3 = 0,042 mole de triglycéride ( oléine).
3.6. En réalité, on
obtient une quantité d’oléine inférieure à celle qui est prévue.
Proposer une explication.
La réaction n'est pas totale, une partie de l'oléine peut être
hydrolysée.
Exercice 2 : IRC et acidose
.
L’acidose est un trouble de l’équilibre acido-basique du sang. Les
reins ne jouant plus correctement leur rôle de filtre lors d’une IRC,
le sang a tendance à s’acidifier. L’équilibre acido-basique du sang
peut être rétabli grâce à un traitement continu à base de gélules qui
contiennent de l’hydrogénocarbonate de sodium ou en buvant
régulièrement une eau minérale riche en ions hydrogénocarbonate.
1.L’ion
hydrogénocarbonate est la base du couple (CO2,H2O)
/ HCO3–. Le pKa de ce couple vaut 6,3.
1.1. Donner la
définition d’une base selon Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un
proton H+.
1.2. Tracer le
diagramme de prédominance des espèces (CO2,H2O)
et HCO3–.
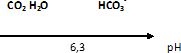
1.3. Le pH de l’eau
minérale recommandée est égal à 6,6. À l’aide du diagramme précédent,
déduire quelle espèce du couple acido-basique prédomine dans cette eau
minérale.
A pH supérieure au pKa ( 6,3) , la forme base ( HCO3–) du couple prédomine.
|
|
|
2. Les
gélules prescrites pour corriger le pH du sang peuvent contenir de 0,50
g à 1,00 g d’hydrogénocarbonate de sodium NaHCO3. Pour le
vérifier, on réalise les manipulations suivantes a) Dans une fiole
jaugée de volume V égal à 50,0 mL, on dissout une gélule dans de l’eau
distillée.
b) On prélève un volume VB de la solution obtenue, égal à
25,0 mL, qu’on introduit dans un bécher.
c) On réalise un dosage avec suivi pH-métrique en utilisant une
solution d’acide chlorhydrique de concentration molaire CA égale à 0,50 mol L-1.
2.1.
Indiquer le matériel qui doit être utilisé pour prélever avec précision
les 25,0 mL de la solution préparée.
Un volume précis est prélevé à l'aide d'une pipette jaugée.
2.2. On dispose du
matériel suivant :
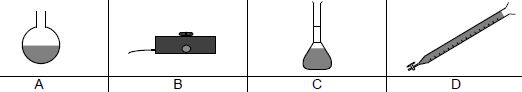
2.2.1. Nommer les objets A, B, C et
D.
A : ballon ; B : agitateur magnétique ; C : fiole jaugée ; D : burette
graduée.
2.2.2.
Identifier le matériel adapté pour réaliser le dosage par suivi
pH-métrique.
Agitateur magnétique, burette graduée; sonde du pHmètre + interface ;
becher.
2.3. Le tracé de la
courbe de suivi pH-métrique conduit à l’obtention d’une des deux
courbes suivantes. Expliciter le choix de la courbe dont la forme est
représentative du dosage.
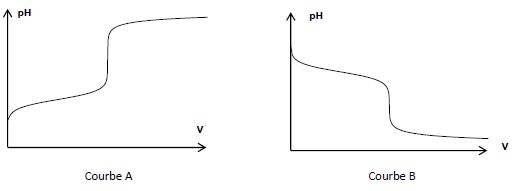
Initialement le becher contient la solution d'hydrogénocarbonate, de pH
supérieur à 6,3, puis le pH diminue au cours du titrage, ajout d'acide
chlorhydrique. Courbe B.
2.4. Par une
méthode graphique, on trouve que l’équivalence est atteinte après avoir
versé un volume d’acide VA,éq égal à 10,0 mL.
2.4.1. Donner la
définition de l’équivalence.
A l'équivalence, les quantités de matière de réactifs mis en présence
sont en proportions stoechiométriques.
2.4.2. La
concentration molaire en hydrogénocarbonate de sodium, dans la solution
dosée, est notée CB. Montrer que cette concentration CB
est égale à 0,20 mol L-1. A l’équivalence, on rappelle la
relation : CA x VA,éq = CB x VB.
CB =
CA x VA,éq / VB
= 0,50 *10,0 / 25,0 = 0,20 mol / L.
2.4.3. En déduire que la quantité
d’hydrogénocarbonate de sodium nB, contenue dans la fiole
jaugée de 50,0 mL, vaut 0,010 mol.
nB = 0,20 *50 / 1000 = 0,010 mol.
2.4.4. En déduire
la masse m d’hydrogénocarbonate de sodium contenue dans une gélule.
Donnée : masse molaire de l’hydrogénocarbonate de sodium M = 84,0
g mol-1.
m = nB M = 0,010 *84,0 = 0,84 g.
2.4.5. Déterminer
si la valeur trouvée est en accord avec celle attendue. Justifier la
réponse.
Les gélules prescrites pour corriger le pH
du sang peuvent contenir de 0,50 g à 1,00 g.
0,84 est bien dans l'intervalle 0,50 ; 1,00 g.
|
|
|
|
Exercice 3 :
Les traitements de l’IRC L’IRC est actuellement impossible à guérir.
Les patients sont soumis à des traitements de type dialyse pour pallier
la défaillance des reins. Cette technique fait appel à une membrane qui
joue le rôle de filtre et sert à éliminer les toxines et les excès de
liquide du sang.
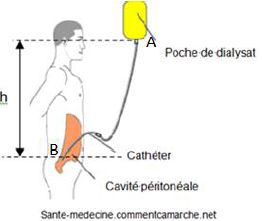
1.La dialyse
péritonéale.
C’est le péritoine, double membrane tapissant la paroi abdominale, qui
joue le rôle de filtre. On installe un cathéter (petit tube flexible)
entre les deux membranes grâce auquel on introduit un liquide appelé
dialysat. Les toxines et les liquides passent dans le dialysat. Une
fois l’opération terminée, on vide le dialysat par le même cathéter.
Cette technique se passe à domicile, dure environ huit heures et peut
s’adapter aux besoins du patient.
1.1. Donner l’unité
de la pression dans le Système International.
Pascal ( Pa).
1.2. Pour pouvoir
pénétrer dans la cavité, le dialysat doit arriver à l’extrémité du
cathéter avec une pression pB de 1,10 x 105 SI.
Calculer la différence de pression Dp qui existe entre la
sortie de la poche et l’extrémité du cathéter.
Donnée : pression à la sortie de la poche supposée constante pA
= 1,00 x 105 SI.
Dp = pB-pA
= 1,1 105 -1,0 105 =
1.3. La loi fondamentale de la statique des fluides relie la
différence de pression Dp
au dénivelé h entre deux points :
pB – pA = r x g x h
1.3.1. Donner la
signification de la grandeur représentée par la lettre r
1.3.2. Préciser son
unité dans le Système International.
Masse volumique du
fluide exprimée en kg m-3.
1.3.3. Déterminer
la hauteur minimale h à laquelle il faut placer la poche de dialysat,
par rapport à la cavité péritonéale, pour que le contenu de la poche
pénètre dans la cavité.
Données : g = 10 N.kg-1 ; r = 1,1 x 103
SI.
h = pB – pA / ( r x g) = 1,0 104
/ (1,1 103 *10) ~ 0,91 m .
1.3.4. Expliquer
comment on doit placer la poche à la fin de l’opération pour y
recueillir le dialysat pollué. Justifier la réponse.
On place la poche 91 cm plus bas.
|
2. L’hémodialyse.
Cette opération d’épuration du sang nécessite un dialyseur, machine
couramment appelée « rein artificiel ». Le sang est aspiré au moyen
d’une pompe dans un circuit externe, épuré et réinjecté au patient. Les
toxines et les liquides se retrouvent dans un dialysat qui est éliminé
en fin d’opération. Celle-ci a lieu en milieu hospitalier, trois fois
par semaine. Chaque opération dure environ quatre heures.
2.1. Donner la relation entre le débit volumique D, le volume de fluide
écoulé V et la durée d’écoulement Dt.
D = V / Dt .
2.2. Donner l’unité
du débit dans le Système International.
m3 s-1.
2.3. Le débit
volumique de retrait du sang lors d’une hémodialyse est de 0,25 L min–1.
Une hémodialyse dure environ quatre heures. Montrer que le volume de
sang V qui passe dans la machine est égal à 60 litres.
0,25 *4*60 = 60 L.
2.4. L’organisme
d’un patient dialysé contient cinq litres de sang. Déterminer le nombre
de passages du sang du patient dans la machine lors de l’hémodialyse
pour être épuré.
60 / 5 = 12 passages.
2.5. Il peut
arriver que la membrane de filtration se rompe, ce qui entraîne un
passage du sang dans le dialysat. Celui-ci se colore. Une telle fuite
peut être détectée grâce à un rayonnement infrarouge qui passe au
travers du dialysat. À l’aide de l’échelle des rayonnements suivante,
indiquer dans quel intervalle de longueurs d’onde se trouve le
rayonnement utilisé.
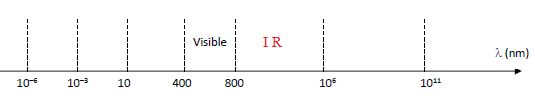
Les longueurs d'onde de l'infrarouge s'étendent de 800 à 106
nm.
3. Comparaison des
deux techniques
En utilisant les informations données dans l’exercice concernant les
deux techniques possibles, proposer un avantage et un inconvénient de
la dialyse péritonéale par rapport à l’hémodialyse.
Avantage : elle s'effectue à domicile.
Inconvénient : sa durée est de 8 heures au lieu de quatre pour
l'hémodialyse.
|
|