Techniques
physico-chimiques de détection de médicaments contrefaits.
Bas S Métropole 09/2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
L’Organisation
Mondiale de la Santé alerte sur le commerce illicite de médicaments
contrefaits qui s’étend aujourd’hui à l’échelle mondiale. On peut citer
l’exemple d’un sirop contre la toux dans lequel l’un des excipients, le
glycérol, a été substitué par un antigel toxique, l’éthylène glycol.
1. Comparaison des propriétés du glycérol et de l'éthylène glycol.
1.1. A quelle famille de composés organiques appartiennent le glycérol et l'éthylène glyol ?
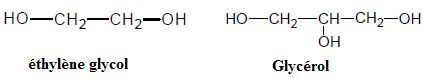
Ce sont des polyols. Ces molécules possèdent plusieurs fonctions alcools.
1.2. Quelle(s) caractéristique(s) commune(s) au glycérol et l'éthylène glycol rend(ent)-elle(s) possible la contrefaçon d'un sirop ?
Ces liqudes sont transparents, incolores, au goût sucré, miscibles avec
les solvants polaires comme l'eau. Ajoutons que leur indice de
réfraction sont assez proches.
1.3. Proposer une interprétation pour rendre compte de la grande différence de température d'ébullition de ces deux molécules.
Le point d'ébullition des alcools est élevé en raison du groupement hydroxyle qui permet des liaisons hydrogène.
Le point d'ébullition des alcools est d'autant plus élevé que :
- le nombre de fonction alcools est grand ;
- la chaîne carbonnée est longue.
2. Différentes techniques pour distinguer le glycérol de l'éthylène glycol.
2.1.Citer deux techniques expérimentales non spectroscopiques permettant de distinguer le glycérol de l'éthylène glycol.
Mesure de la masse volumique ( pesée du même volume de chaque liquide ).
Détermination de la température d'ébullition sous une pression de 1 bar.
2.2. Spectroscopie infrarouge.
2.2.1. Quelle information sur une molécule un spectre infrarouge permet-il d'obtenir ?
La spectroscopie IR permet d'identifier des liaisons, des groupes
caractéristiques et de mettre en évidence la liaison hydrogène.
2.2.2. La spectroscopie IR est-elle pertinente pour repérer un sirop contrefait à l'éthylène glycol ? Jusifier.
Non, les molécules sont trop proches l'une de l'autre : elles possèdent
toutes deux des fonctions alcool et aucun groupe caractéristique
différent.
|
|
|
2.3. Spectroscopie RMN du proton.
2.3.1. La
spectroscopie RMN du proton permet-elle de distinguer le glycérol de
l'éthylène glycol ? Justifier si le spectre suivant est celui du
glycérol ou celui de l'éthylène glycol.

D’après http://sdbs.db.aist.go.jp
Le glycérol compte deux groupes de protons équivalents, en plus des
protons alcooliques. On observe deux multiplets sur ce spectre RMN et
un singulet pour les protons alcooliques..
L'éthylène glycol compte 4 protons équivalents et les deux protons
alcooliques. Le spectre RMN comporte deux singulets, la hauteur de l'un
étant le double de la hauteur de l'autre.
2.3.2. La
spectroscopie de RMN du proton est une méthode adaptée pour connaître
la structure d’un composé pur ; elle est par contre mal adaptée pour
analyser les constituants d’un mélange
contenant un grand nombre d’espèces chimiques et reconnaître ainsi un sirop contrefait. Justifier
cette affirmation.
Dans le cas d'un mélange, le spectre RMN compte un très grand nombre de
signaux. Ces derniers peuvent se superposer en partie, il sera
difficile de trouver les protons couplés d'une même molécule.
3. Spectrométrie de masse à temps de vol.
Le spectromètre à temps de vol est un dispositif permettant d’analyser
les constituants d’un mélange. Une petite quantité du mélange liquide à
analyser est injectée dans une enceinte où règne un vide poussé appelée
chambre d’ionisation. Le liquide se vaporise et les molécules présentes
dans le gaz sont ionisées de sorte qu’elles se retrouvent sous forme
d’ions mono-chargés de charge q = e. Ces ions pénètrent dans la chambre
d’accélération où ils acquièrent une vitesse v sous l’action d’un champ
électrique uniforme. Les ions les plus légers acquièrent une vitesse
plus grande que les ions les plus lourds. Les ions parcourent ensuite
une distance d connue, dans une zone où ne règne pas de champ
électrique (tube de
vol). Un détecteur à la sortie du tube de vol permet de mesurer le temps de vol Dt
, durée nécessaire aux ions pour parcourir la distance d. La mesure des
temps de vol caractéristiques de chaque ion permet d’identifier les
différents constituants d’un mélange.
|
|
|
|
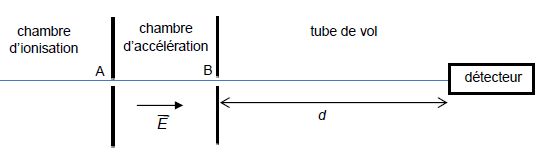
La chambre d’accélération est constituée de deux plaques métalliques parallèles positionnées en A et B. Une tension UAB positive est appliquée entre ces deux plaques, produisant un champ électrique uniforme E .
On pourra négliger l’influence du poids des ions dans la chambre d’accélération.
3.1.1. Pourquoi les molécules constituant le mélange doivent-elles être ionisées à l’entrée de la chambre d’accélération ?
Seuls les ions sont soumis à une force électrique dans la chambre
d'accélération. Les molécules neutres ne sont soumise à aucune force
électrique dans cette chambre. Seuls les ions positifs seront accélérés
dans cette chambre.
Un ion, de charge électrique q = e et de masse m, se déplace dans la
chambre d’accélération entre les deux plaques. L’effet du champ
électrique E
est tel que la variation d’énergie cinétique de l’ion entre les deux
plaques A et B est égale au travail de la force électrique F s’exerçant
sur lui entre A et B.
On étudie le mouvement de l’ion dans le référentiel du laboratoire supposé galiléen.
3.1.2. En faisant l’hypothèse que la vitesse initiale de l’ion est nulle au point A, montrer que l’expression de la vitesse vB de l’ion en B est :
vB = [2eUAB / m]½.
Travail de la force électrique F entre A et B : W = e UAB.
Variation de l'énergie cinétique d'un ion : ½mv2B-0.
Théorème de l'énergie cinétique entre A et B : ½mv2B = e UAB.
v2B = 2e UAB / m ; vB = [2eUAB / m]½.
3.1.3. En déduire
l’influence de la masse de l’ion sur la valeur de sa vitesse et
justifier en la citant une des phrases du texte d’introduction sur le
spectromètre à temps de vol.
La vitesse de l'ion est inversement proportionnelle à la racine carrée de sa masse.
"Les ions les plus légers acquièrent une vitesse plus grande que les ions les plus lourds".
3.2. Parcours dans le tube de vol
L’ion pénètre dans le tube de vol de longueur d = 1,50 m avec la vitesse vB précédente dont l’ordre de grandeur est un million de km.h-1. On peut considérer le mouvement de l’ion dans le tube de vol comme rectiligne uniforme.
3.2.1. Montrer que, dans ces conditions, la masse m de l’ion s’exprime ainsi :
m = 2eUAB ( Dt / d)2.
Le mouvement de l’ion dans le tube de vol comme rectiligne uniforme : vB = d / Dt.
v2B = (d / Dt)2.
De plus : v2B =2eUAB / m.
Par suite : m = 2eUAB ( Dt / d)2.
3.2.2. Le spectromètre à temps de vol est réglé avec les paramètres suivants : UAB = 25,0 kV ; d = 1,50 m. On introduit un échantillon pur dans la chambre d’ionisation. Le temps de vol mesuré est : Dt = 6,56 µs. S’agit-il de glycérol ou d’éthylène glycol ?
m = 2*1,6 10-19 *25,0 103 ( 6,56 10-6 / 1,5)2=1,53 10-25 kg.
Masse d'un ion issu du glycérol : M(glycérol) / NA =92,1 10-3 / (6,02 1023)=1,53 10-25 kg.
Masse d'un ion issu de l'thylène glycol : M(éthylène glycol) / NA =62,1 10-3 / (6,02 1023)=1,03 10-25 kg.
Il s'agit donc du glycérol.
3.2.3.
La résolution du spectromètre à temps de vol permet de distinguer deux
espèces chimiques si l’écart entre leurs temps de vol est supérieur à
20 nanosecondes. Cette technique permettrait-elle de distinguer un
sirop contre la toux produit dans un laboratoire pharmaceutique de sa
contrefaçon ?
Différence de masse correspondante : 2*1,6 10-19 *25,0 103 ( 20 10-9 / 1,5)2=1,43 10-30 kg.
Différence de masse entre un ion issu du glycérol et un ion issu de l'éthylène glycol : 5 10-26 kg.
Cette technique permet de distinguer le sirop de sa contrefaçon.
|
|