Une micropile à
combustible.
Bac S Asie 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
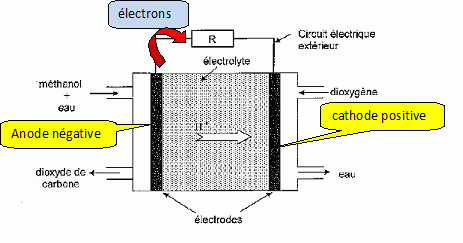
Une pile à combustible ( PAC) est un assemblage de cellules
élémentaires, comprenant deux électrodes contenant un catalyseur ( le
plus souvent du platine), séparées par un électrolyte, dont le rôle est
de permettre la migration des ions d'une électrode à l'autre.
Le comburant est du dioxygène. le combustible est le plus souvent du
dihydrogène. Ce combustible gazeux à température ambiante et
inflammable, pose des problèmes de stockage.
Un autre combustible possible est le méthanol. Ce combustible est
certes toxique, mais liquide à température ambiante. Il est produit
principalement à partir du gaz naturel. On se dispense ainsi du
problème de stockage du dihydrogène. Une telle pile à combustible
est appelée DMFC ( Direct Methanol Fuel Cells). L'électrolyte utilisé
est acide.
 Question préalable.
Question préalable.
Vérifier que l'énergie volumique de la batterie d'un téléphone est en
accord avec les données énergétiques des batteries usuelles.
Dimensions de la batterie : h = 62 mm ; largeur : 50 mm ; épaisseur : 5,0 mm.
Li-ion :3,8 V ; 7,98 Wh.
Volume de la batterie : V = 6,2 *5,0 *0,50 =15,5 cm3.
Energie volumique : 7,98 / 15,5~ 0,51 Wh cm-3.
Cette valeur correspond à l'énergie volumique d'une batterie Li-ion.
|
|
|
Problème.
Dans
l'hypothèse de l'utilisation d'une micropile DMFC, calculer la taille
du réservoir de méthanol assurant la même autonomie au téléphone ( 2
jours) qu'une batterie Li-ion et exercer un regard critique sur la
valeur trouvée.
Donées concernant le méthanol : CH3OH ; densité 0,792 ; M = 32 g/mol.
Liquide et vapeur très inflammables ; toxyque par contact cutané ou inhalation ; cancèrogène.
|
|
|
|
Une réduction se produit à la cathode positive :
O2(g) + 4H+aq + 4e- = 2 H2O(l).
Une oxydation se produit à l'anode négative :
CH3OH aq + H2O(l)= CO2(g) + 6H+aq + 6e-
L'équation associée à la réaction lorsque la pile débite est :
2CH3OHaq + 3 O2(g) = 2CO2(g) + 4 H2O(l).
La tension de fonctionnement de cette pile est de 0,50 V.
Il va donc falloir associer 8 piles en série pour obtenir une tension proche de 3,8 V.
Energie électrique disponible E = 7,98 *3600 = 2,873 104 J.
Charge électrique de la pile Q = E / U = 2,873 104 / 0,50 = 5,746 104 C.
Quantité de matière d'électrons : ne = Q / F = 5,746 104 / (9,65 104)=0,595 mol.
Quantité de matière de méthanol : n = ne / 6 =9,924 10-2 mol.
Masse de méthanol : m = n M(méthanol) = 9,924 10-2 *32= 3,18 g
Volume de méthanol : V = m / densité = 3,18 / 0,792 ~4,0 cm3.
Tenir compte du rendement da pile DMFC ( 40 %) :
4,0 /0,40 ~10 cm3.
C'est à peu près le volume de la batterie du téléphone ; tous les deux
jours il va falloir remplir le réservoir et il faut compter avec les
dangers de l'utilisation du méthanol ( inflammable et toxique ).
|
|