QCM : acide base,
synthèse organique.
Concours kiné EFOM 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
8.
Une solution aqueuse S est préparée en dissolvant 5,0 10-4
mol d'un acide AH dans de l'eau distillée. Le volume final est V = 500
mL. le pH de cette solution est 4,00.
- La concentration molaire en soluté apporté est 1,0 mmol/L. Vrai.
c=5,0
10-4 / 0,500 =0,0010 mol/L = 1,0 mmol/L.
- Dans cette solution les ions oxonium sont plus concentrés que les
ions hydroxyde. Vrai.
Le pH est inférieur à 7.
- L'acide AH est fort. Faux.
Dans l'hypothèse d'un acide fort
: pH = - log c =-log 0,0010 = 3,0.
- Si la forme acide prédomine dans S alors le pKa du
couple (AH / A-) est supérieur à 4,0. Vrai.
A pH < pKa, la forme acide
AH prédomine.
9.
Lors d'une synthèse de l'acide 4-aminobenzoïque, on recueille 300 mg
d'un solide blanc. Afin de vérifier sa pureté, on dissout m = 274 mg de
ce solide dans V =100 mL d'eau distillée. On procède au titrage de la
totalité de la solution aqueuse ainsi réalisée par une solution aqueuse
d'hydroxyde de sodium de concentration molaire cB =0,100
mol/L. VE = 18,0 mL.
M( acide4-aminobenzoïque) =M = 137 g/mol.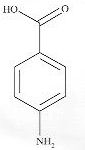
- Cet acide contient une fonction acide
carboxylique et une fonction amide. Faux.
Cet acide contient une fonction acide
carboxylique et une fonction amine.
- La
dissolution de cet acide doit être réalisée dans une burette graduée de
100 mL. Faux.
Dans une fiole jaugée de 100
mL.
- Dans ce titrage pH-métrique le volume VE correspond à
l'abscisse du maximum de la courbe dérivée dpH/dvB. Vrai.
- Le pourcentage massique d'acide 4-aminobenzoïque dans le solide blanc
est de 90 % . Vrai.
A l'équivalence, n(
acide) =n(hydroxyde de sodium= CB VE =0,100*18,0
10-3 =1,8 10-3 mol.
Soit en masse : 137*1,8 10-3
=0,2466 g.
% massique en acide : 0,2466 /0,274 =0,9.
|
| .
. |
|
|
10. Synthèse du
paracétamol.
Para-aminophénol + anhydride éthanoïque --> paracétamol + acide
éthanoïque.
C6H7NO +C4H6O3
---> C8H9NO2 +C2H4O2.
Dans un ballon muni d'une agitation mécanique et d'un réfrigérant à
eau, introduire 10,9 g de para-amminophénol. Introduire 30 mL d'eau
puis 10,2 mL d'anhydride éthanoïque.
Porter l'ensemble à reflux pendant 30 minutes.
Refroidir puis transvaser dans un becher.
Refroidir dans un bain de glace : le paracétamol précipite.
Filtrer sous vide et laver à l'eau glacée.
Essorer sur papier filtre puis à l'étuve.
On obtient une masse de produit P sec : mP= 6,0 g.
|
.
|
|
Masse molaire : para-aminophénol MPa =109 g/mol ; paracétamol Mpc =151 g/mol ; anhydride éthanoïque Mac =102 g/mol.
Masse volumique de l'anhydride éthanoïque : r =1,0 g/mL.
- Le para-aminophénol est le réactif en excès. Faux
Initialement : npa =10,9 / 109 = 0,10 mol ; nac =10,2 /102 = 0,1 mol. Les réactifs sont en proportions stoechiométriques.
- Le chauffage à reflux permet d'accélérer la réaction. Vrai.
- Il est impossible d'obtenir plus de 15,1 g de paracétamol pur en suivant le protocole décrit. Vrai.
On peut obtenir au mieux 0,1 mol de paracétamol soit 15,1 g.
- Le rendement de cette synthèse est inférieur à 0,5. Vrai.
6,0 / 15,1 ~0,4.
|
|
|