Pile
; tomographie par émission de positons.
Concours GEIPI 2015( Sti2d)
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Exercice
3.
On
sait par expérience que le cuivre métallique est attaqué chimiquement
s’il est plongé
dans une solution d’ions Fe3+. L’analyse
chimique au cours de la réaction met en évidence
l’apparition d’ions ferreux et cuivriques (respectivement Fe2+
et Cu2+).
Equilibrer l’équation-bilan de cette réaction.
2Fe3+aq
+Cu(s) ---> 2Fe2+
aq + Cu2+aq.
Préciser
parmi les espèces chimiques présentes celle qui joue le rôle d’oxydant
et
celle qui joue le rôle de réducteur lors de la réaction.
L'oxydant Fe3+aq
se
réduit en Fe2+
aq ; le réducteur Cu(s) s'oxyde en Cu2+aq.
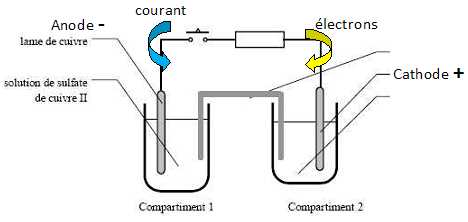
Réalisation d’une pile
:
On réalise maintenant le dispositif expérimental suivant, dans lequel
les concentrations sont :
Compartiment 1 : solution de sulfate de cuivre : [CuSO4]
= 0,01 mol.L-1.
Compartiment 2 : solution de chlorure de fer II [FeCl2]
= 0,01 mol.L-1 + chlorure de fer III [FeCl3]
= 0,01 mol.L-1.
Le pont salin est quant à lui constitué d’une solution gélifiée de
chlorure de potassium de
concentration massique [KCl] = 75 g.L-1.
Pourquoi
le pont salin est composé ions ?
Un solide
ionique conduit le courant électrique.
Calculer la concentration molaire de la solution du pont salin.
M(KCl)= 39,1
+35,5 =74,6 g/mol ; 75 / 74,6 ~1,0
mol/L.
Fonctionnement
de la pile :
On ferme l’interrupteur.
Compléter le schéma en précisant :
a. la polarité + / - des deux électrodes
b. le sens du courant dans le conducteur ohmique
c. le sens du courant dans le pont salin s'il existe.
d. la nature des électrodes : anode ou cathode : compartiment 1 -
compartiment 2
e. les réactions électrochimiques : compartiment 1 - compartiment 2
Le cuivre
s'oxyde ( compartiment 1) et joue le rôle d'anode négative.
Cu(s) = Cu2+aq + 2e-.
Les ions Fe3+ aq se réduisent ( compartiment 2)
; le platine joue le rôle de cathode positive.
Fe3+aq +e- = Fe2+aq.
Dans le pont salin on observe une double migration des ions en sens
contraire. Migration des ions chlorure vers le compartiment 1 ;
migration des ion potassium vers le compartiment 2.
.
|
| .
. |
|
|
Après 60 minutes, on peut
mesurer que la masse électrode de cuivre a diminué de 88,9 mg ;
Quelle quantité (en mol) de cuivre métal a été consommée ?
n = 88,9 10-3 / 63,5 = 1,4 10-3 mol.
Quelle est la quantité d’électricité (en C) échangée pendant
ces 60 minutes ?
n(e-) = 2n = 2,8 10-3
mol.
Q = F n(e-) =96500 *2,8 10-3 =2,7 102 C.
Quelle a été l’intensité moyenne du courant électrique débité par la
pile pendant ce
temps (I moyenne sur 60 minutes) ?
I = Q / t =
2,7 102 / (60*60) =7,5 10-2 A.
|
.
|
|
Exercice
4.
La TEP Tomographie par Emission de Positons s ( ß+
) est une technologie de médecine nucléaire qui utilise des molécules
marquées avec un isotope émetteur de positons pour
imager le fonctionnement ou le dysfonctionnement d’organismes vivants.
On utilise principalement le fluorodesoxyglucose FDG marqué au fluor 18
pour ce type d’examen.
Production du radio-isotope émetteur de positon.
Le 189F ou fluor 18 est
produit dans un cyclotron en bombardant par des protons de haute
énergie une cible contenant du 188O,
un isotope de l’oxygène.
Ecrire la réaction nucléaire correspondant à la formation de 18F
et nommer les produits de la réaction.
188O
+11p --->189F + 10n ( neutron).
Le fluor 18 se
désintègre par émission ß+ , produisant de
l’oxygène dans son état fondamental.
Donner la composition du noyau de fluor 18.
9 protons
et 18-9 = 9 neutrons.
Ecrire la réaction nucléaire de désintégration du 18F
et nommer les produits de cette réaction.
189F ---> 188O
+01e( positon).
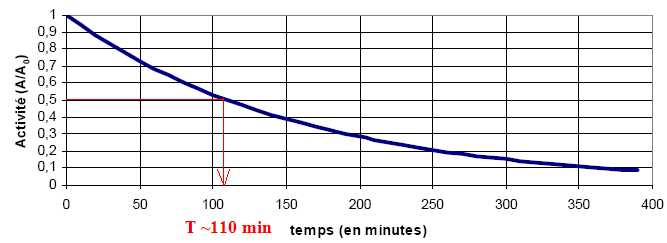
La courbe de
décroissance de l'activité de la source radioactive tracée ci-dessous a
pour équation : A(t) =A0 exp(-lt). l = 1,05 10-4
s-1.
Déterminer la période de
demi-vie t1/2 du fluor 18.
Préparation du FDG
marqué au fluor 18 et injection au patient.
Un automate permet de remplacer un groupement OH du glucose par du
fluor 18, la molécule marquée obtenue a des propriétés analogues au
glucose normal que l’on injecte
au patient. Un tissu organique anormal (par exemple une tumeur
cancéreuse) consomme plus de glucose qu’un tissu sain et concentre donc
la radioactivité. On injecte à un patient à
10 heures une dose de solution glucosée présentant une activité
importante. On ne laisse sortir le patient que lorsque son activité
n’est plus que 1% de sa valeur initiale.
A quelle heure pourra t’il quitter la salle d’examen (donner le
résultat à l’heure près) ?
A(t) =0,01A0=A0
exp(-lt)
; ln 0,01 = -lt ;
t = -ln0,01 / l =-ln0,01 /(1,05 10-4)~4,4 104 s ~ 12 h.
Heure de sortie 10 +12 = 22 h.
Détection
des positons émis.
Les positons émis avec une vitesse initiale non nulle sont freinés par
collisions avec les atomes et s’arrêtent après quelques mm. Un positon
au repos s’annihile avec un électron
produisant une paire de photons g de
même énergie se propageant dans des directions opposées.
Le dispositif détecte les photons émis en coïncidence avec une caméra
spéciale entourant la tête ou le corps du patient. Un traitement
mathématique permet de remonter à la
concentration en fluor 18.
Pourquoi les capteurs ne détectent pas directement les
positons ?
Les positons
s'annihilent rapidement avec les électrons.
.Ecrire l’équation de la réaction d’annihilation du positon.
01e +0-1e = 200g.
|
|
|
Radioprotection du
personnel hospitalier.
Il faut une couche de plomb d’épaisseur x1/2 = 4
mm pour diminuer de moitié le rayonnement g
produit. Le patient est placé dans une enceinte de plomb d’épaisseur 3,2
cm. Quel est le pourcentage de rayonnement transmis à l’extérieur ?
32 /4 = 8 ; rayons gamma
transmis à lextérieur : 1/ 28=1 / 256 ~4 10-3 ( 0,4 %).
|
|
|