Connaissances
générales physique et chimie. Concours
technicien ITRF Reims
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. Connaissances générales.
A quelmultiple ou sous multiple, exprimé en puissance de 10,
correspondent les préfixes suivants :
déci : 10-1 ; micro : 10-6
; hecto : 102 ; téra :1012 ; femto : 10-15
; milli : 10-3 ; pico : 10-12
;
giga : 109 ; nano : 10-9
; atto : 10-18.
2 -Compléter
le tableau.
| Grandeur |
Courant
électrique |
Résistance
électrique |
Puissance |
Energie |
Viscosité
dynamique
|
Pression |
| Unités |
Ampère |
Ohm |
Watt |
Joule |
Poise |
Pascal |
| Symbole |
A |
W |
W |
J |
P ou Po
|
Pa |
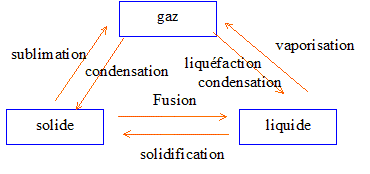
3. Changement d'état
de la matière. Indiquer sur le schéma les trois états de la matière
ainsi que les noms des six changements d'état.
4. Qu'est ce qu'un
plasma ?
"soupe" d'électrons très actifs dans laquelle "baignent" des ions ou des noyaux atomiques.
5.
Compléter le tableau.
| Valeur
numérique |
96500 |
1,6
10-19 |
6,02 1023 |
3,0 108 |
6,63
10-34 |
| Nom |
Faraday |
Charge
élémentaire |
Nombre
d'Avogadro |
Célérite
de la
lumière dans le vide |
Constante
de
Planck |
| Unité |
C
mol-1 |
C |
mol-1 |
m s-1 |
J s |
6. Compléter le
schéma électrique en plaçant un voltmètre et un ampremètre de façon à
déterminer la valeur de la résistance R. E = 9 V ; r = 4,2 ohms ; I =
0,2 A. Indiquer les sens du courant. Donner la tension mesurée aux
bornes de la résistance.
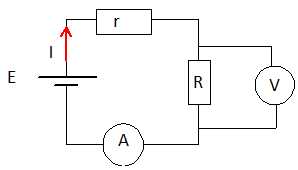
E = rI + RI ; RI =9-4,2*0,2 = 8,16 V.
|
| ..
. |
|
|
7. Citer :
un conducteur électronique : cuivre ; un semi-conducteur dopé n(P) : silicium dopé au bore ;
un diélectrique : le verre.
8. propriétés des longueur d'onde.
Quelle est la relation entre la longueur d'onde et la fréquence ? l = c
/ n.
Quelle est la vitesse de la lumière dans le vide ? : 3 108
m s-1.
Comment varie la vitesse de la lumière dans un autre milieu ?
v = c / n avec n : indice de réfraction du milieu.
Quel est l'indice optique de l'air ? n =1.
Dans le spectre des ondes électromagnétique, compléter le tableau :
| Longueur
d'onde |
>
10 cm |
de
1 mm
à 10 cm |
de
1 µm
à 500 µm |
de
400
à 800 nm |
de
10 nm
à 400 nm |
de
10-8 à 10-11 m |
de
10-12
à 10-14 m |
| Domaine |
radio |
micro-onde
et radar |
IR
|
Visible |
UV |
RX |
gamma |
620 à 700 nm : rouge ; 592 à 620
nm : orange ; 578 à 592 nm : jaune ; 500 à 578 nm :
vert ;
446 à 500 nm : bleu ; 400 à 446 nm ; violet.
9. Calculer la
moyenne, l'écaert type, l'incertitude absolue et l'incertitude relative.
|
|
|
|
|
Moyenne |
Ecart
type |
| Epaisseur
( nm) |
101,4 |
99,9 |
103,2 |
102,5 |
101,75 |
1,44 |
| Indice
n |
1,458 |
1,457 |
1,463 |
1,462 |
1,46 |
2,94
10-3 |
Incertitude
absolue : 103,2-99,9 = 3,3 nm ; inertitude relative : 3,3 / 101,75 ~3,2
10-2 ( 3,2 %).
Incertitude
absolue : 1,463 -1,457 = 6 10-3 ; inertitude
relative :6 10-3 / 1,46 ~4,1 10-3
( 0,41 %).
|
|
|
|
10. Quel type de
pompe est nécessaire pour obtenir un vide de l'ordre de 10-2
mbar dans une enceinte ?
Le vide primaire est obtenu à l'aide de pompe à palettes.
Quel appareil adapté sur l'enceinte permettra de mesurer la pression ?
Jauge à ionisation.
Citer en quelques uns avec des gammes de mesures compatibles.
Manomètre de Bourdon. Pression supérieure à 104 Pa.
Jauge à ionisation : jusqu'à 10-2 Pa.
Jauge de Penning : jusqu'à 10-4 Pa.
Chimie.
1. Que représente A et Z dans l'écriture suivante AZX ?
A : nombre de masse, nombre de nucléons ; Z : n° atomique, nombre de protons.
Pour cet atome, combien son noyau contient-il de protons et de neutrons ? Quel est le nombre d'électrons ?
Z protons, Z électrons et A-Z neutrons.
2. Donner la configuration électronique des atomes suivants dans leur état fondamental :
146C : 1s2 2s2 2p2 ; 126C : 1s2 2s2 2p2 ; 2311Na : 1s2 2s2 2p6 3s1 .
3. Compléter le tableau..
| Nom | Argon | Mercure | Tungstène | Or | Antimoine | Cuivre | Magnésium | Hélium | | Symbole | Ar | Hg | W | Au | Sb | Cu | Mg | He | Etat physique
20°C ; 1 bar | gaz | liquide | solide | solide | solide | solide | solide | gaz |
Sous
quel état chimique stable ( formule) et état physique trouve-t-on les
éléments ou composés suivants ( 298 K et 1 bar) ?
Chlore : Cl2 gaz ; azote : N2 gaz.
Chlorure d'hydrogène : HCl gaz ; sulfure de dihydrogène : H2S gaz ; hydroxyde de sodium : NaOH solide.
4. Composition de l'air, nature des gaz et masse d'air.
N2, diazote ( 79 % en volume) ; dioxygène O2 ( 20% ) ; argon ( ~1 %).
Masse volumique de l'air à 20°C sous 1 bar : 1,3 kg m-3.
Il s'agit de la distance parcourue par le solvant.
5. Définir le pH d'une solution aqueuse et calculer le pH des solutions suivantes.
pH= - log [H3O+aq].
HCl, c = 10-3 mol/L : pH = - log c= 3.
HCl, c = 10-8 mol/L. [HO-] = 10-6 mol/L ; pH = 14+og 10-6 = 8.
CH3COOH, c = 0,01 mol/L.
pH = ½pKa -½log c = 0,5*4,8 -0,5 log 0,01 = 3,4.
6. On veut préparer 200 mL dune solution 0,02 molaire d'acide oxalique C2O4H2 à partir du solide C2O4H2 ,2H2O.
Décrire les opérations à effectuer.
M(C2O4H2 ,2H2O) =126 g/mol.
n = 0,2*0,02 =4 10-3 mol ; masse à peser : 126*4 10-3 = 0,504 ~0,50 g.
Balance de précision, coupelle et spatule pour peser le solide.
Verser dans une fiole jaugée de 200 mL contenant 1/3 d'eau distillée : agiter jusqu'à dissolution complète.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène.
7.
Pour préparer 1 L de solution HCl à 0,5 mol/L, on dispose d'un flacon
de solution commerciale : d = 1,15 ; % massique 37% ; M = 36,46 g/mol.
Décrire les opérations à effectuer.
Masse d'acide dans 1 L de solution commerciale : m = 1,15 *0,37 = 0,4255 kg = 425,5 g
Concentration C = 425,5 / 36,46 ~11,7 mol/L.
Facteur de dilution F = 11,7 / 0,5 =23,3.
Volume de solution commerciale à prélever ( à l'aide d'une burette graduée) = 1000 / 23,3 ~43 mL.
Verser dans une fiole jaugée de 1,00 L contenant 1/3 d'eau distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène.
Par cette méthode peut-on préparer une solution HCl à 0,500 mol/L ? Justifier.
Non, l' indication de l'étiquette " teneur minimale 37 %" n'est pas assez précise.
8. Dosage.
Pour déterminer
la concentration exacte de la solution précédente, on dispose d'une
solution d'hydroxyde de sodium ( 0,100 mol/L et du matériel de
laboratoire nécessaire. Décrire le prorocole du dosage à l'aide d'un
indicateur coloré.
La soude est dans la burette graduée de 20 mL.
Le becher contient 20 mL de solution acide, prélevé à l'aide d'une pipette jaugée, et quelques gouttes de BBT.
Le becher est placé sur un agitateur magnétique.
Ajouter lentement la soude jusqu'à décoloration de l'indicateur.
|
|
|
|