Spectroscopie,
dosage eugénol ( CPG). Concours
ITRF Rennes
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
2 - Dosage du sodium par absorption atomique.
(12 points)
On veut doser le sodium dans une eau minérale à l’aide de la méthode
des ajouts dosés.
On dispose d’une solution mère (A) à 50 g/L de Na pour préparer les
étalons.
On propose pour cela de préparer 500 mL d’une solution à 200 ppm
(solution C) à partir de la
solution mère (A) :
2.1 : Calculer le
volume de la solution mère(A) à prélever pour préparer C (1 point) .
200 ppm ou 200 mg par L ou 0,20 g / L.
Facteur de dilution : F = 50 / 0,20=250.
Il faut prélever 500 / 250 = 2 mL de la solution mère.
2.2 : On prépare
ensuite 100 mL (fiole de 100 mL) de chacun des étalons suivants (E0,
E1, E2, E3,
E4)
.Compléter le tableau ci-dessous pour obtenir une gamme d’étalonnage
allant de 0 à 0,8 ppm de Na connu. Expliquer le calcul du volume de la
solution C à ajouter dans chacune des fioles.
| Etalon |
E0 |
E1 |
E2 |
E3 |
E4 |
| Volume
d'eau minérale ( mL) |
5 mL |
| Concentration
en Na (ppm) |
0 |
0,2 |
0,4 |
0,6 |
0,8 |
| Volume
de solution C ( mL) |
0 |
0,1 |
0,2 |
0,3 |
0,4 |
| On complète à 100 mL
avec de l'eau déminéralisée. |
Pour E1, le
facteur de dilution est F = 200/0,2 = 1000.
Volume de solution C à prélever : 100 / 1000 = 0,1 mL
2.3 : On dispose
de 3 micropipettes : Gamme de 10-200 µL ou gamme de100-1000 µL ou gamme
de 0,5 -5 mL.
2.3-a : Laquelle
doit-on prendre pour préparer la solution C ? (1 point).
Gamme de 0,1 à 5 mL.
2.3-b : Laquelle
doit-on prendre pour préparer les étalons ? (1 point).
Gamme de100-1000 µL.
2.4 : L’analyse des
étalons, obtenus avec le spectromètre AA6200 (avec une flamme
air-acétylène) a donné les résultats suivants :
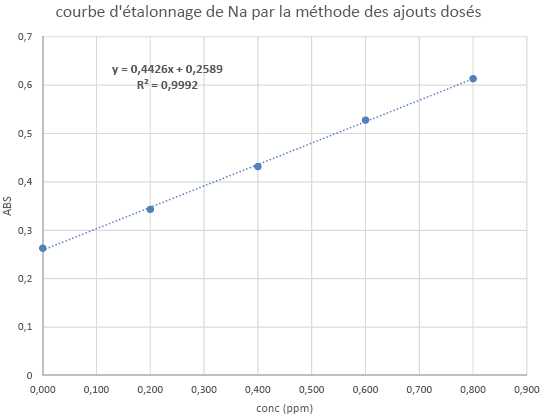
A
partir de ces résultats, donner la concentration en Na de l’eau
minérale à analyser en mg/L. Justifier votre calcul. (4 points).
Dans E0,
la concentration en élément sodium,
apporté uniquement par l'eau minérale, est notée c0.
A0 = k c0, avec k une constante.
Ai =A0+kci avec i = 1, 2, 3, 4. k
=0,4426 ppm-1.
c0 = A0 / k =0,2589 / 0,4426 = 0,585 ppm.
|
| .
. |
|
|
3 - Préparation de soude diluée à partir de
soude concentrée. (5 points)
On dispose de soude technique concentrée à 30,8% en masse (solution
aqueuse liquide).
On veut préparer 100 litres de soude à 4 mol/L. On trouve dans la
littérature les données suivantes à 15°C :
| masse
volumique ( kg m-3) |
Concentration
de la soude aqueuse ( kg m-3) |
| 1120 |
121,0 |
| 1140 |
143,7 |
| 1154 |
160,0 |
| 1180 |
191,4 |
Il
y a une évolution linéaire entre les deux valeurs du tableau.
3.1 : Calculer la
masse totale des 100 litres de soude à 4 moles par litre à partir des
données du
tableau. (2 points). M(NaOH) = 40 g/mol = 0,040 kg / mol.
4 mol L-1 = 4000 mol m-3 = 4000 *0,040 kg m-3
= 160 kg m-3.
Masse volumique de la solution : 1154 kg m-3 ; masse de 100
L de solution : 115,4 kg.
3.2 : Calculer
alors les masses de soude technique liquide et d’eau à utiliser pour
obtenir cette masse totale. (3 points).
Quantité
de matière de soude dans 100 L : n = 400 mol ; masse de soude :
400*0,040 =16 kg provenant de la solution technique à 30,8 % en masse
de soude.
16 / 0,308=51,95 kg de solution technique et 115,4-51,95 = 63,45
kg d'eau.
|
|
|
|
4 -Réaction d’oxydo-réduction (6
points)
On
dose 100 mL d’une solution contenant du sulfate ferreux 0,001 mol/L et
du sulfate ferrique 0,002 mol/L par une solution de KMnO4
0,02 mol/L en milieu acide.
Données : Potentiel standard : E°(Fe3+/Fe2+) =
+0,77V/ESH ; E°(Fe2+/Fe) = - 0,47V/ESH ; E°( MnO4-
/Mn2+) = 1,491V/ESH
4.1 :
Ecrire la ou les réactions de titrage d’oxydo- réduction. (1 point)
5Fe2+aq = 5 Fe3+aq + 5e-.
MnO4-aq + 8H+aq +5e- = Mn2+aq
+ 4H2O.
MnO4-aq
+ 8H+aq +5Fe2+aq
= Mn2+aq + 4H2O +5
Fe3+aq.
4.2 : Calculer le volume de
permanganate de potassium à verser à l’équivalence. (1 point)
n(Fe2+) =0,001 * 100 = 0,1
mmol. A l'équivalence : n(Fe2+)
= 5 n(MnO4-)
= 5*0,02 VE ; VE
=1,0 mL.
4.3
: Calculer le potentiel par rapport à ESH, pris par une électrode de
platine plongeant dans la solution, à la demi-équivalence. (2 points).
A
la demi équivalence : 0,05 mmol d' ion fer (II) a disparu et il s'est
formé 0,05 mmol d'ion Fe (III) soit au total 0,25 mmol dans
environ 100 mL de solution. [Fe2+]=
0,05 / 100 = 5 10-4 mol/L ; [Fe3+]=
0,25 / 100 = 2,5 10-3 mol/L.
E = E°(Fe3+/Fe2+)
+0,06 log( [Fe3+] /
[Fe2+])
= 0,77 +0,06 log ( 25/5)=0,81 V.
4.4:
Que se passerait-il si on portait artificiellement le potentiel de
l’électrode précédente à 0,85 V/ESH, puis à 0,75 V/ESH ?
A
0,85 V/ESH : [Fe3+]
croît, donc oxydation des ions fer (II).
A 0,75
V/ESH : [Fe2+]
croît, donc réduction des ions fer (III).
5 - Gaz parfait (5 points)
L’air est considéré comme un gaz parfait.
Calculer la masse volumique de l’air pour une pression atmosphérique
normale à la température de 20°C.
Volume
d'une mole d'air : V = 8,31*293 / 105 = 2,435 10-2
m3.
Masse d'une mole d'air ( 20 % dioxygène et 80 % diazote) : m = 0,20 *32
+0,8 *28=28,8 g = 2,88 10-2 kg.
µ = 2,88 / 2,435 =1,18 kg m-3.
6- Dosage de l’eugénol
(t°ébullition = 254°C) dans l’essence de girofle par chromatographie en
phase gazeuse avec
étalonnage interne. (10 points)
Condition de l’analyse chromatographique :
Colonne : HP.INNO Wax (polyéthylène glycol : PEG) 15m x 0.53mm, ef =1mm.
Gaz vecteur : Azote, pression d’entrée : 210 kPa
Chromatographe : HP 4890, injecteur : 260°C, mode « split », rapport de
division 100/4. Four : 185°C
Détecteur : détecteur à ionisation de flamme (FID) : 200°C
H2 : pression d’entrée 150kPa. Air : pression d’entrée :
300kPa.
L’étalon interne est une solution de diphényl (T°ébulition =255°C) à la
concentration de 70 g.L-1 dans l’acétone (T°ébulition
acétone = 56°C).
On prépare 5 étalons en pesant précisément une masse d’eugénol pur
auquel on ajoute 1 mL de la solution d’étalon interne
| Etalon |
Masse
d'eugénol pesée ( mg) |
Etalon
interne ( diphényl) |
| 1 |
322,8 |
1 mL |
| 2 |
367,4 |
| 3 |
401,5 |
| 4 |
431,3 |
| 5 |
468,8 |
On
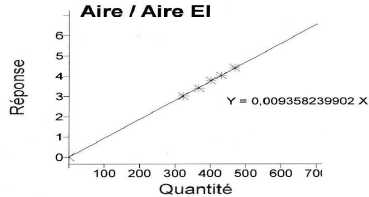
injecte successivement 0,1mL de chacun des étalons préparés. Sur chaque
chromatogramme, on mesure l’aire du pic de l’eugénol et l’aire du pic
de diphényl. Les résultats sont rassemblés dans le tableau suivant et
sur la courbe d’étalonnage.
| Etalon |
Aire
du pic
eugénol ( Aire) |
Aire
du pic
diphényl ( aire EI) |
Aire
/ Aire EI |
masse
eugénol (mg) |
| 1 |
87,40 |
29,04 |
3,01 |
322,8 |
| 2 |
96,68 |
28,44 |
3,40 |
367,4 |
| 3 |
108,09 |
28,60 |
3,78 |
401,5 |
| 4 |
122,4 |
30,45 |
4,02 |
431,3 |
| 5 |
115,36 |
26,16 |
4,41 |
468,5 |
|
|
|
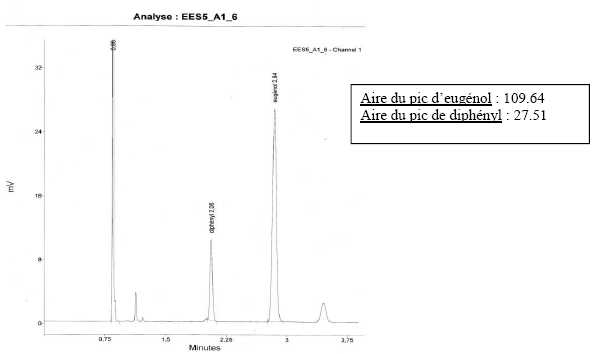
Analyse de l’essence de girofle :
On injecte 0,1 mL de l’échantillon à analyser.
Préparation de l’échantillon à analyser : 506 mg d’essence de girofle +
1 mL d’étalon interne.
On obtient le chromatogramme suivant :
6.1 : Quel est le
matériau de la phase stationnaire ? (1 point)
Polyéthylène glycol.
6.2 : La phase
stationnaire est-elle polaire ou apolaire ? Justifier.
La présence des atomes d'oxygène électronégatifs confère un caractère
polaire à la phase stationnaire.
6.3 : Cette phase-
a-t-elle plus d’affinité pour les composés polaires ou apolaires ?
Justifier. (1 point)
Cette
phase polaire peut établir des liaisons avec les espèces polaires.
La phase a peu d'affinité pour les espèces apolaires.
6.4 : Quel est le
composé le plus polaire entre l’eugénol et le diphényl ? Justifier. (1
point)
L'eugénol possède une fonction phénol et une fonction ester ; le
diphényl a une stucture ne comportant
que des atomes de carbone. L'eugénol est plus polaire que le diphéhyl.
6.5 : A quel
composé correspond le pic au temps de rétention de 0,85 min ? (1 point)
Acétone, composé le plus volatil.
6.6 : Calculer la
masse d’eugénol contenu dans l’échantillon d’essence analysée.
Détailler votre calcul (5 points)
Y =Aire pic eugénol / aire pic diphényl = 109,64 / 27,51 = 3,985.
Y = 0,009358 meugénol ; meugénol = Y / 0,009358 =3,985 / 0,009358 =426 mg.
|
|