Automobile :
combustion de l'essence, pile à combustible.
Concours général Stl 2012
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
par
explosion (combustion soudaine) d'un mélange air+carburant. On parle
alors de moteur à explosion. La
quasi-totalité des automobiles sont équipées d'un moteur dit "à quatre
temps" dont le principe de
fonctionnement simplifié est illustré dans la figure suivante :
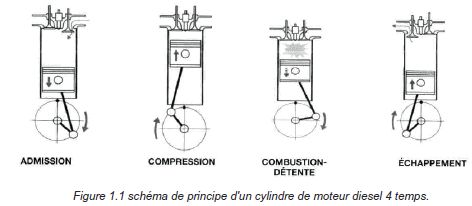
A la fin de l'admission (PMB) le volume du cylindre est Vmax
et à la fin de la compression (PMH) le volume du
cylindre est Vmin.
L’admission –
compression :
On suppose que le mélange air + carburant qui entre dans le cylindre au
cours de l'admission se comporte comme un gaz parfait dont la
température T, la pression P et le volume V sont reliés par l'équation
: P V = n R T avec P exprimée en pascals (Pa), n le nombre de moles et
R la constante des gaz parfait valant 8,31 J.K–1.mol–1.
Donner
la valeur de T0, la température en
kelvins, correspondant à une température 0°C.
T0 = 273 K
Montrer
que le volume molaire VCNTP occupé par une mole
de ce mélange dans les conditions normales de température et de
pression (CNTP) c'est-à-dire pour P = 1,013×105 Pa
et 0°C est de 22,4 L.mol–1.
VCNTP =RT0 /P =8,314*273/(1,013 105)
=0,0224 m3 mol-1 = 22,4 L mol-1.
On définit plus pratiquement les conditions habituelles de température
et de pression (CHTP) pour lesquelles la température est de 20°C et la
pression de 1,013×105 Pa.
On appelle VCHTP le volume occupé par une mole de mélange
dans ces conditions. Calculer sa valeur.
VCHTP
=RT /P =8,314*293/(1,013
105) =0,0240 m3 mol-1 = 24 L mol-1.
On
considère un véhicule de cylindrée totale 1600 cm3
comportant 4 cylindres.
Donner
la valeur de la cylindrée unitaire Cu correspondant au
volume d'un cylindre. On supposera que ce volume est le volume
du cylindre lorsque le piston est au point mort bas (PMB). On notera Vmax
ce volume.
Cu=Vmax
=1600
/ 4 = 400 cm3 = 0,40 L.
Calculer le nombre
de moles de mélange ntot introduites dans
chaque cylindre à la fin de l'admission en supposant que l'admission se
fait dans les conditions CHTP.
n
tot= Vmax
/VCHTP
=0,40 / 24 = 0,010 mol.
On
définit de façon simplifiée le taux de compression du moteur t = Vmax / Vmin
où Vmin est le volume du mélange enfermé dans un cylindre
lorsque le piston est au point mort haut ( PMH). Sachant que la
température atteinte au cours de la compression est Ta =570
K, calculer la
pression maximum Pmax atteinte par le
mélange dans le cylindre si t = 20.
Pmax = ntot RTa t/ Vmax =0,010 *8,314
*570 *20 /(4 10-4) =2,37 106 ~2,4 106
Pa.
|
| ..
.. |
|
|
La combustion
complète.
Le mélange compressé est alors dans les conditions thermodnamiques lui
permettant de s'enflammer. On considèrera la combustion du
mélange constitué d'air et d'un hydrocarbure de formule brute C8H18.
Densité du carburant à l'état liquide : d=0,775.
Ecrire
l'équation bilan de la combustion complète de C8H18
liquide, en présence de dioxygène gazeux.
C8H18(l) + 12,5O2(g)
= 8 CO2(g) + 9 H2O(g).
Déterminer la masse
d'un litre de carburant liquide pur.
m = V d = 1*0,775 = 0,775 kg = 775 g.
Montrer qu'n litre
de carburant contient 3,3 moles.
M(C8H18) = 18*12+18=234 g/mol.
n = m / M(C8H18)=775 / 234 =3,312~3,31 mol.
Déterminer
le nombre de moles nO2 et le volume VO2, dans les
conditions CHTP, de dioxygène nécessaires pour brûler, dans les
conditions stoechiométriques, un litre de cet hydrocarbure. En déduire
le volume d'air.
nO2 = 12,5 n = 12,5*3,312 =41,4 mol ; VO2 = nO2 VCHTP
=41,4*24 =994 L.
L'air contient en volume environ 20 % de dioxygène : V=994*5 =4,97 m3.
L'un des produits est le CO2. Quel est le nom de ce composé
; calculer la masse de CO2 rejetée par an,par un véhicule
parcourant 15 000 km an-1. ( consommation 5 L aux 100 km).
Pour 1 L de carburant brûlé, quantité de matière de dioxyde de carbone
: nCO2=8*3,312 =26,496 mol.
Masse correspondante : nCO2M(CO2)=26,496
*44 =1,1658 kg.
Consommation annuelle du véhicule : 150*5 =750 L.
Masse de CO2 rejetée par an : 750*1,1658=874 kg.
Quels
sont les effets du CO2 sur l'environnement
?
Le dioxyde de carbone contribue à l'effet de serre et au réchauffement
global.
|
.
|
|
La
pile à combustible.
Une alternative
au moteur à explosion est le moteur électrique. Une pile à combustible
produit de l'électricité à partir d'un mélange de dioxygène et de
dihydrogène et d'un catalyseur, le platine.
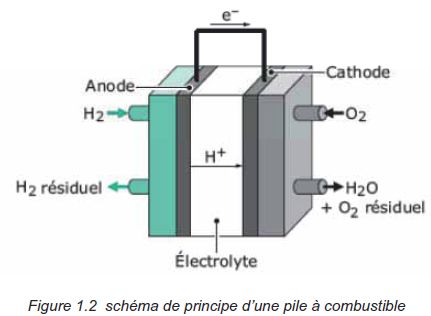
A l'anode, le dihydrogène est oxydé : H2 = 2H++2e-.
A la cathode, le dioxygène est réduit : O2 + 4H++4e-=
2H2O.
Le bilan global est donc : O2 + 2H2=
2H2O.
Dans les véhicules électriques équipés, les piles à combustibles sont
constituées d'un empilement de cellules électrochimiques élémentaires
branchées en série ( leur nombre est de l'ordre de 100 ).
On rappelle qu'un courant de 1 A correspond à la circulation d'une
charge de 1 C par seconde.
Déterminer la charge
totale en coulomb correspondant à 1Ah.
1 Ah correspond à un
courant de 1 A circulant pendant une heure ou 3600 s. 1Ah = 3600 C.
Quel est le nombre
d'électrons produits par mole de dihydrogène consommé ?
H2 = 2H++2e-.
: deux moles d'électrons sont produites par mole de dihydrogène
consommé soit 2NA = 2*6,02 1023 = 1,2 1024
électrons.
En déduire qu'une
pile à combustible peut produire 2,7 104 Ah par kg de
dihydrogène consommé.
Chaque électron transporte une charge |q| = 1,6 10-19
C ;
1,6 10-19 * 1,2 1024 =1,926 105 C soit 1,926 105 /3600 =53,5
Ah par mole de dihydrogène.
M(H2) = 2,0 g/mol ; Q=53,5 *1000 /2 ~2,7 104 Ah
par kg de dihydrogène.
Calculer l'énergie
électrique WE produite par cette pile, fonctionnant sous une
tension U = 0,7 V par kg de dihydrogène consommé.
WE = Q U = 2,7 104 *3600*0,7
=6,741 107 ~6,7 107 J ~ 67 MJ par kg de dihydrogène.
Le pouvoir énergétique d'une pile à combustible est évalué à W = 142 MJ
par kg de dihydrogène consommé.
Toute l'énergie
produite par l'oxydoréduction est-elle disponible sous forme d'énergie
électrique ? Justifier.
L'énergie produite par
l'oxydoréduction est disponible sous forme d'énergie électrique (
67 MJ ou 67/1,42 ~47 %) et sous forme d'énergie thermique ( effet
Joule).
On suppose que le rendement électrique de la pile est de 50 % et que
celui des moteurs électriques est de 90%.
Calculer le
rendement global d'un véhicule électrique équipé de cette pile et le
comparer à celui d'un moteur thermique.
Rendement global : 0,5 *0,90 = 0,45 %, bien supérieur à celui d'un
moteur thermique ( ~30 %).
Quels sont les avantages et les inconvénients d'une telle technologie alternative ?
Avantage : pas de production de dioxyde de carbone et de particules fines.
Inconvénients : faible autonomie ; le dihydrogène constitue un mélange explosif avec le dioxygène.
|
|
|