Méthodes
pour déterminer le taux d'alcoolémie.
Concours général Stl 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Pour
déterminer le taux d’alcoolémie, la police dispose de plusieurs
méthodes qualitatives ou quantitatives, par analyse de l’air expiré ou
par analyse du sang. En effet, lorsque qu’une personne consomme une
boisson alcoolisée, l’alcool (éthanol) commence à passer immédiatement
dans le sang, essentiellement au niveau de l'estomac et de l'intestin,
pour être distribué ensuite dans tout l'organisme. La quasi-totalité de
l'alcool présent dans le sang est alors progressivement oxydée par le
foie (la quantité non transformée est éliminée via l'haleine, les
urines et la sueur).
Analyse de l’air expiré (air alvéolaire).
Le
principe de cette analyse repose sur l’élimination pulmonaire de
l’éthanol avec, à l’équilibre, une quantité moyenne d’éthanol identique
dans 1,00 mL de sang et 2,10 L d’air expiré. Un examen rapide, mais
qualitatif et peu fiable, peut être effectué à l’aide d’un alcootest ou
d’un éthylotest.
Principe de l’alcootest.
Après
une inspiration forcée et une apnée de 30 s pour atteindre l’équilibre
sang/air, on fait passer l’air expiré, en une fois, à travers un tube
contenant un mélange d’acide sulfurique H2SO4, de gel de silice et de dichromate de potassium K2Cr2O7.
Le dégagement de chaleur, entraîné par la réaction entre l’humidité de
l’air expiré et l’acide sulfurique, est alors suffisant pour que
l’éthanol réduise le dichromate de potassium jaune orangé en sels verts
de chrome III.
Quels composés
peut-on obtenir par oxydation d’un alcool primaire ? Décrire, pour
chacun d’eux, le/les test(s) permettant de les caractériser.
Par oxydation ménagée, un alcool primaire s'oxyde en aldehyde puis en acide carboxylique.
Un aldehyde donne un test positif à la liqueur de Fehling bleue : celle-ci donne un précipité rouge brique.
Un acide carboxylique est mis en évidence par le papier indicateur universel de pH ( pH < 7).
Dans
quels composés naturels potentiellement présents dans la bouche
trouve-t-on la fonction aldéhyde ? En déduire une explication de la
non-spécificité du l’utilisation de l’alcootest.
La salive peut contenir des molécules possédant la fonction aldehyde.
De
plus, l’alcootest est à usage unique et présente un très gros
inconvénient : le dichromate de potassium est fortement toxique,
corrosif, cancérigène et dangereux pour l'environnement
Associer
chacun des qualificatifs énoncés pour le dichromate de potassium à l’un
des pictogrammes (numérotés de 1 à 5 de gauche à droite).

1 : comburant ; 2 : corrosif ; 3 : toxique ; 4 : cancérigène ; 5 : danger pour l'environnement.
Principe de fonctionnement de l'éthylotest.
Dès la mise en marche, le capteur est alimenté et équilibré, le voyant vert clignote, un bip retentit et l’indication
«
PRÊT » s’affiche attestant de la disponibilité de l’éthylotest. La
personne souffle avec force et de façon régulière dans l’embout
hygiénique buccal à usage unique. L’appareil contrôle la pression, le
débit et la durée du souffle, puis
prélève automatiquement en fin d’expiration 1,0 cm3 d’air alvéolaire. Quand le signal sonore continu s’arrête et que le
voyant
vert s’éteint, le dépistage est terminé. L’échantillon prélevé est
exposé sur le capteur qui fonctionne par oxydo-réduction. De l’aldéhyde
acétique se forme à partir de l’éthanol, libérant des électrons. Le
courant
généré est évalué par un microprocesseur et converti en mesure proportionnelle sur l’indicateur.
Le résultat final du test apparait en quelques secondes.
Justifier la
phrase « de l’aldéhyde acétique (éthanal) se forme à partir de
l’éthanol, libérant des électrons » et pourquoi « le courant généré
peut donner une mesure proportionnelle sur l’indicateur».
L'oxydation de l'éthanol en aldehyde libère des électrons : C2H6O = C2H4O + 2H++2e-.
La quantité de matière d'électrons n(e-) est égale à deux fois la quantité de matière d'éthanol.
La quantité de matière d'électrons est proportionnelle à l'intensité du courant.
|
| ..
.. |
|
|
Principe de l’éthylomètre.
L’éthylomètre,
comme l’éthylotest, permet de mesurer la quantité d'alcool dans le
souffle. La mesure est donnée généralement en grammes par litre de
sang. Lorsque la quantité d'alcool dépasse le taux légal en vigueur, un
signal sonore retentit. L’éthylomètre permet d’apporter la preuve
légale de l’imprégnation éthylique. Il fonctionne sur le principe de
l’analyse d’un spectre Infra Rouge entre 3,3 et 3,5 μm (liaison H-C) ou
à 9,5 μm (liaison O-C).
Le spectre IR de l’éthanol est reproduit ci-dessous.
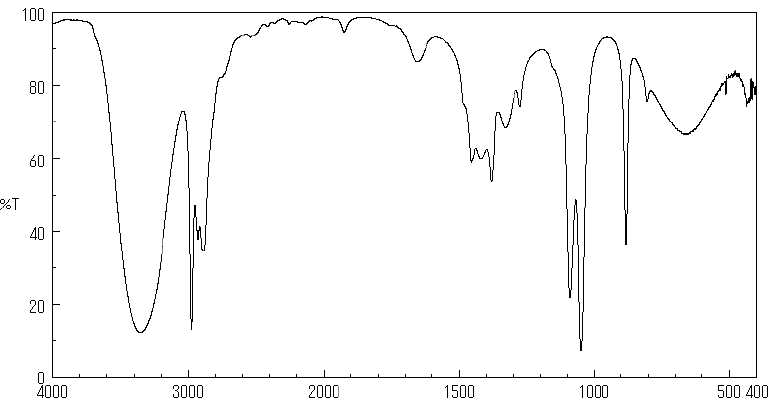 Indiquer la relation entre nombre d’onde et longueur d’onde. Indiquer la relation entre nombre d’onde et longueur d’onde.
Le nombre d'onde est l'inverse de la longueur d'onde exprimée en cm.
Retrouver, sur le spectre, les bandes citées dans le principe de l’appareil « entre 3,3
et 3,5 μm (liaison H-C) ou à 9,5 μm (liaison O-C) » et indiquer à quel
type de vibrations correspondent ces différentes bandes.
3,4 µm = 3,4 10-4 cm ; nombre d'onde : 1/(3,4 10-4) =2940 cm-1 ( vibration élongation C-H).
9,5 µm = 9,5 10-4 cm ; nombre d'onde : 1/(9,5 10-4) =1050 cm-1 ( vibration élongation C-O).
Le spectre de l’éthanol présente une bande forte et large vers 3360 cm-1. Indiquer
à quelle vibration correspond cette bande (liaison concernée et type de
vibration). Expliquer pourquoi on ne peut pas se référer à cette bande
pour détecter la présence d’éthanol dans le souffle.
Vibration
O-H lié : bande large et forte due aux liaisons hydrogène multiples
entre molécules d'éthanol. La surface de cette bande dépend du nombre
de liaisons hydrogène, très variable.
|
.
|
|
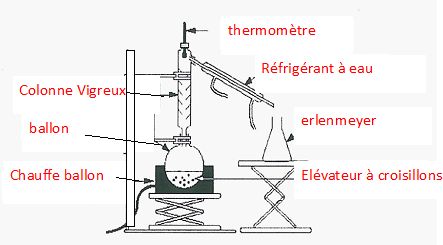
Analyse du sang par la méthode chimique de Cordebard .
L’éthanol
contenu dans le sang est séparé par distillation, en présence d’acide
picrique qui a une action défécatrice et antimousse. Le distillat est
recueilli dans une fiole jaugée contenant de l’eau
distillée et
placée dans un bain réfrigérant. La solution aqueuse d’éthanol est
alors mise en présence d’une solution nitrochromique (mélange d’acide
nitrique et de dichromate de potassium) à froid et en excès. L’excès
d’ions dichromate est dosé en retour par iodométrie. Un essai à blanc
est pratiqué en parallèle par remplacement de la solution aqueuse
obtenue à partir du distillat par de l’eau distillée.
Dosage de l’éthanol contenu dans le sang de Monsieur Blank.
On prélève un volume V0 = 5,00 mL de sang que l'on dissout dans 75 mL d'acide picrique. On distille et on récupère un volume V1 = 50,00 mL de distillat contenant la totalité de l'alcool (le distillat est une solution aqueuse d’éthanol appelée S1 dont la concentration molaire en éthanol est notée C1). Dans un erlenmeyer, on introduit des volumes V2 = 20,00 mL de distillat et V3 = 10,00 mL d'un mélange nitrochromique de concentration molaire C3 = 2,17×10-2 mol.L-1 en ions dichromate. On bouche l’erlenmeyer et on laisse la réaction se dérouler 10 min, puis on ajoute un volume V4 = 10,0 mL d'iodure de potassium de concentration molaire C4, telle que les ions iodure I- soient en excès. On dose le diiode formé par une solution de thiosulfate de sodium de concentration molaire C5 = 8,00×10-2 mol.L-1. Le volume versé pour atteindre l'équivalence est V5 = 10,95 mL.
Essai à blanc : on répète la même opération avec 5,00 mL d'eau distillée et 75 mL d'acide picrique. On traite le volume V'2 = 20,00 mL de distillat selon le même ordre opératoire. Le dosage du diiode formé nécessite un volume V'5 = 16,25 mL de thiosulfate de sodium pour atteindre l’équivalence.
Faire un schéma annoté du montage de distillation.
Écrire
l’équation de la réaction d’oxydation de l’éthanol par les ions
dichromate qui conduit à la formation de l’acide éthanoïque. En déduire
la relation entre la quantité de
matière d’éthanol contenu dans la prise d’essai et la quantité de matière d’ions dichromate ayant réagi avec l’éthanol.
3 fois{ C2 H6
O +H2O= C2H4 O2 + 4 électrons + 4H+}.
2 fois{Cr2O72- + 6 electrons +14 H+
= 2 Cr3+ + 7 H2O}.
3 C2 H6 O + 2Cr2O72-
+28 H+ +3H2O---> 3 C2H4 O2 + 4 Cr3+
+ 12 H+ + 14 H2O.
3 C2 H6 O + 2Cr2O72-
+16 H+ ---> 3 C2H4 O2 + 4 Cr3+ + 11 H2O. n(alcool) =1,5 n(Cr2O72-).
Justifier, sans calcul, le sens d'évolution de cette réaction.
L'ion dichromate est l'oxydant le plus fort ; l'éthanol est le réducteur le plus fort..
Pourquoi, pour doser l’éthanol, est-il nécessaire d’utiliser les ions dichromate en excès ?
Il ne faut pas s'arrêter au stade éthanal ; tout l'éthanol doit être oxydé en acide éthanoïque, d'où l'excès d'oxydant.
Déterminer
la relation entre la quantité de matière de diiode formé et la quantité
de matière d’ions dichromate introduite en excès (ions dichromate
n’ayant pas réagi avec l’éthanol).
Cr2O72- + 6 e- +14 H+
= 2 Cr3+ + 7 H2O.
3 fois{2I- = I2 +2e-}.
Cr2O72- + 6 I- +14 H+
= 2 Cr3+ +3I2 +7 H2O. n (I2)=3 n(Cr2O72-)excès.
De
même, exprimer la relation entre la quantité de matière d’ions
dichromate en excès et la quantité de matière d’ions thiosulfate
introduite à l’équivalence.
I2 +2e-= 2I-.
2S2O32- = S4O62- + 2e-.
I2 +2S2O32- = S4O62- +2I-. n(I2) =½n(S2O32-). Par suite : 3 n(Cr2O72-)excès =½n(S2O32-) ; n(Cr2O72-)excès =n(S2O32-) / 6 = C5(V'5-V5)/6 =8,00 10-2*5,3 /6=7,067 10-2 mmol.
En
déduire la relation entre la quantité de matière totale d’ions
dichromate, la quantité de matière d’éthanol contenue dans le volume V2 de distillat et la quantité de matière d’ions thiosulfate introduite à l’équivalence.
n(Cr2O72-) totale =n(S2O32-) blanc/ 6 =C5V'5/6=8,00 10-2*16,25 /6=0,2167 mmol.
n(Cr2O72-) oxydant l'alcool =n(Cr2O72-) totale - n(Cr2O72-)excès =C5V'5/6-C5V5/6 =C5(V'5-V5)/6 =0,2167-7,067 10-2 =0,146 mmol.
n(alcool) =1,5n(Cr2O72-) oxydant l'alcool =1,5 C5(V'5-V5)/6=C5(V'5-V5)/4=0,080(16,25-10,95) /4 =0,106 mmol.
Déterminer la concentration molaire puis la concentration massique de la solution aqueuse d’éthanol S1.
0,106 mmol d'éthanol dans V2=20 mL soit : C1=C5(V'5-V5)/(4V2)=0,106/20 = 5,3 10-3 mol/L ou 5,3 10-3 *46,0 =0,2438 ~ 0,244 g/L.
En déduire la concentration massique en éthanol dans le sang prélevé.
V1C1 =50 * 5,3 10-3 =0,265 mmol d'éthanol dans 5 mL de sang soit : 0,265/5=5,3 10-2 mol/L ou 5,3 10-2*46 =2,44 g/L.
Quel est l’intérêt expérimental majeur de cet essai à blanc ?
Cela évite de connaître la concentration en ion dichromate, qu'elle soit précise ou non.
|
|
|