Structure de la
matière, équilibre d'oxydo-réduction.
Concours CPR Maroc 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Spectre
de l'atome d'hydrogène.
L'existence du spectre d'émission de l'atome
d'hydrogène, soumis
à une irradiation a été prouvée expérimentalement bien avant la théorie
de Bohr. Les nombres d'onde s
des divers raies sont empriquement liés par la relation : sp-->n = RH(1/n2-1/p2)
avec n <p, entiers différents de zéro.
1. L'expression de
la longueur d'onde lp-->n en fonction de RH, n et p est :.
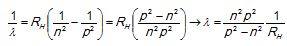 Réponse C. Réponse C.
2. L'expression de l'énergie d'un
niveau En est :
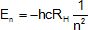 Réponse
C. Réponse
C.
3. L'énergie
minimale pour ioniser un tel atome est :
n=1 ; RH =1,097 107 m-1 ;
E =6,626 10-34 *2,997 108 *1,097
107 =2,178 10-18 J. Réponse A.
4.
Les valeurs de la longueur d'onde de la première et de la dernière raie
de la série de Lyman sont n=1 ; p=2 : l1 =4 / (3*1,097
107)= 1,22 10-7
m =122 nm ;
n=1 ; p très grand : llim =1/ (1,097 107)= 9,12 10-8 m =
91,2 nm. Réponse
A.
Orbitales
atomiques, configuration électronique.
5. L'orbitale
atomique caractérisée par n=2, l=1, m=0 est 2pz.
Vrai.
L'orbitale
atomique caractérisée par n=1, l=0, m=0 est 1s. Vrai.
6. La configuration électronique de
l'atome de nickel : ( Z=28)
La configuration 1s2 2s2
2p6 3s2 3p6 4s0 3d10
correspond à l'ion nickel. Faux.
La configuration 1s2 2s2 2p6 3s2 3p8 4s2 3d6 est
interdite. Vrai.
La configuration 1s2 2s2 2p6 3s2 3p6 4s2 3d8 correspond à l'état fondamental de l'atome de
nickel. Vrai.
La configuration 1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p2 correspond à un état excité de l'atome de
nickel. Vrai.
|
| .
. |
|
|
Architecture
moléculaire.
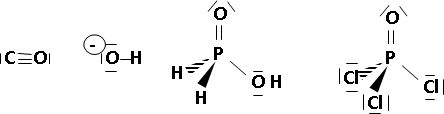
7. 
Espèce
chimique
|
Nombre
de doublet liant
|
Nombre
de doublet
non liant
|
Total
électrons
de valence
|
CO
|
3
|
2
|
10
|
OH-
|
1
|
3
|
8
|
H3PO2
|
5
|
4
|
18
|
POCl3
|
5
|
11
|
32
|
8.
Quel(s) est (sont) l'(les) acide()s de Lewis ?
CCl4 ( faux) ; FCl ( faux) ;
LiCl : Li+ + Cl- , Li+ est
un acide de Lewis ;
BeCl2 est un acide de Lewis ( Le bérylium est
déficient en électrons ).
|
|
|
|
Equilibre
d'oxydo-réduction .
On
mélange deux solutions de même volume V = 50,0 mL et de même
concentration c = 0, 10 mol/L, l'une de sulfate de manganèse et l'autre
de permanganate de potassium.
Il se produit la réaction d'oxydoréduction d'équation bilan :
2MnO4-aq + 3 Mn2+aq +6H2O((l)
= 5MnO2(s) + 4H3O+aq.
Le pH du mélange à l'équilibre vaut 1.
On donne E1 =E°(MnO4-aq /MnO2(s)) =1,70 V ; E2 = E°(MnO2(s) /Mn2+aq) =1,23 V.
9. Expression de E°( MnO4-aq /Mn2+aq ) en fonction de E1 et E2 :
MnO4-aq +4H3O+aq+ 3e-= MnO2(s) +6H2O(l). DG°1 = -3FE1.
MnO2(s) +4H3O+aq+ 2e-= Mn2+aq +6H2O(l). DG°2 = -2FE2.
MnO4-aq +8H3O+aq+ 5e-= Mn2+aq +12H2O(l). DG° = -5FE.
DG° =DG°1 +DG°2 ; 5E = 3E1 +2E2 ; E =(3E1 +2E2 ) / 5 = 1,51 V. Réponse D.
10. La constante d'équilibre à 298 K de cette réaction est :
K = [H3O+aq]4 / ([MnO4-aq]2[Mn2+aq]3).
A l'équilibre E1 = E2 ; 1,70 + 0,02 log 1/([H3O+aq]4 [MnO4-aq] ) = 1,23 +0,03 log ([Mn2+aq] / [H3O+aq]4)
1,70 + 0,06 log (1/([H3O+aq]4/3 [MnO4-aq]1/3 ) = 1,23 +0,06 log ([Mn2+aq]0,5 / [H3O+aq]2)
(1,70 -1,23 ) /0,06 =log ([H3O+aq]2/([H3O+aq]4/3 [MnO4-aq]1/3 [Mn2+aq]0,5).
7,83 =1/6 log ( [H3O+aq]4/ ([MnO4-aq]2 [Mn2+aq]) ) =1/6 log K.
log K = 47 ; K = 1047. Réponse A.
11. Lesconcentrations des ions MnO4- et Mn2+ à l'équilibre sont :
|
Avancemnt (mmol)
|
2MnO4-aq |
+ 3 Mn2+aq |
+6H2O((l) |
= 5MnO2(s) |
+ 4H3O+aq |
initial
|
0
|
cV =5
|
cV = 5
|
Solvant
|
0
|
0
|
à l'équilibre
|
x
|
5-2x
|
5-3x
|
5x
|
4x
|
Mn2+aq est le réactif limitant : 5-3x ~0 ; x ~5/3.
n(MnO4-aq) ~5-10/3) ~5/3 mmol dans 100 mL ; [MnO4-aq] = 5/300 ~0,0167 mol/L.
K =1047 =[H3O+aq]4 / ([MnO4-aq]2[Mn2+aq]3) = 10-4 / ( 0,01672[Mn2+aq]3).
[Mn2+aq]3 ~3,6 10-48 ; [Mn2+aq] ~1,5 10-16 mol/L. Réponse B.
Les deux compartiments d'une pile contiennent les solutions suivantes :
P1 : 100 mL d'une solution contenant des ions Fe2+ ( 0,1 M) et Fe3+(0,1 M) ;
P2 : 100 mL d'une solution contenant des ions Sn2+ ( 0,02 M) et Sn4+ ( 0,02 M).
Dans chaque solution plonge une électrode de platine. Lors du fonctionnement de la pile, se produit l'oxydation de Sn2+ par Fe3+.
E°(Fe3+ / Fe2+) = 0,77 V ; E°(Sn4+ / Sn2+) = 0,15 V.
12. Quelle est la constante d'équilibre associée à la réaction de fonctionnement de la pile ?
Sn2+ aq + 2Fe3+ aq = Sn4+ aq + 2 Fe2+aq ; K = [Sn4+ aq][Fe2+aq]2/ ( [Sn2+ aq][Fe3+aq]2).
Fe3+ +e- = Fe2+ ; E1=0,77 + 0,06log [Fe3+] /[Fe2+]).
Sn4+ +2e- = Sn2+ ; E2=0,15 + 0,03log [Sn4+] /[Sn2+]).
A l'équilibre : E1=E2 : 0,77 + 0,06log [Fe3+] /[Fe2+]) = 0,15 + 0,03 log [Sn4+] /[Sn2+])
0,77 -0,15 = 0,03 log [Fe2+]2 [Sn4+] / ([Fe3+]2[Sn2+])) =0,03 log K :
log K =20,67 ; K = 4,6 1020. Réponse B.
13. Les concentrations finales des ions sont :
|
Avancemnt (mmol)
|
Sn2+ aq |
+ 2Fe3+ aq |
= Sn4+ aq |
+ 2 Fe2+aq |
initial
|
0
|
100*0,02 = 2
|
100*0,1 = 10
|
2
|
10
|
à l'équilibre
|
x
|
2-x =0
|
10-2x = 6
|
2+x = 4
|
10+2x =14
|
Sn2+aq est le réactif limitant : 2-x ~0 ; x= 2 mmol.
[ Sn4+ aq]=4 / 100 =0,04 mol/L ; [Fe3+ aq]=6 /100 = 0,06 mol/L ; [Fe2+ aq]=14 /100 = 0,14 mol/L ; [ Sn2+ aq]=0. Réponse B.
.
|
|
|
.
14. La quantité totale d'électricité fournie par la pile avant de parvenir à l'équilibre vaut :
n(e-) = 2 n( Sn2+ aq) =2* 2 mmol = 4 10-3 mol.
Q = n(e-)F = 4 10-3 *96500 = 386 C. Réponse A. |
|