Structure
de la matière, thermodynamique chimique, chimie des solutions.
Concours ENS 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Structure de la matière.
Le numéro atomique de l'élément iode est Z
= 53.
32.
La configuration électronique de l'atome d'iode dans son état
fondamental s'écrit :
1s2 2s2 2p6
3s2 3p6 4s2
3d10 4p6 4d10
5s2 5p5. Réponse B.
Règle de
Klechkowski :
l'ordre de remplissage des orbitales se fait suivant (n+l) croissant ;
si deux orbitales atomiques ont le même nombre (l+n), celle qui a la
plus faible valeur de n est remplie en premier ( principe de stabilité)
33.
Le nombre d'éllectrons de valence de l'atome d'iode est égal à 7.
Réponse C.
34.
Le nombre d'électrons de l'atome d'iode dont le nombre quantique
secondaire est égal à 2 est égal à 20. ( 3d10
4d10 )
Réponse C.
35.
La famille chimique à laquelle appartient l'iode s'appelle les
halogènes. Réponse B.
36.
Indiquer deux éléments chimiques qui appartiennent à la même famille
que l'iode.
Brome et chlore. Réponses B et C.
37.
Au laboratoire, le diiode pur à 25°C se trouve sous la forme suivante :
solide sous forme de cristaux. Réponse B.
Thermodynamique
chimique.
On se propose d'étudier la synthèse de l'iodure d'hydrogène selon
l'équilibre en phase gazeuse :
H2(g) +I2(g) = 2HI (g)
(1).
Une expérience réalisée à T = 650 K à partir d'un mélange équimolaire n0
conduit à un taux de conversion de 80 %. Les gaz sont
supposés parfaits.
38. La
constante d'équilibre de la réaction (1) vaut :
|
Avancement
( mol) |
H2(g) |
+I2(g) |
=2HI(g) |
| initial |
0 |
n0 |
n0 |
0 |
| à
l'équilibre |
x=0,8
n0 |
0,2
n0 |
0,2
n0 |
1,6n0 |
Nombre
total de moles à l'équilibre : 2n0.
Fractions molaires : H2(g)
et I2(g) : 0,2 n0
/ (2n0
)= 0,1 ; HI(g)
= 1,6n0
/ (2n0
)= 0,8.
Pressions partielles : H2(g)
et I2(g) : 0,1 P ; HI(g)
= 0,8 P.
K = [0,8 P / (0,1P )]2 = 64. Réponse D.
39.
L'enthalpie libre standard de la réaction (1) à T = 650 K est :
DG=
-RT ln K = -8,314*650 ln 64 = -2,25 104 J mol-1
= -22,5 kJ mol-1.
Réponse D.
|
| .
. |
|
|
40. Indiquer
l'influence de la pression sur l'équilibre atteint par la réaction (1),
à température constante.
Le
nombre de moles des réactifs est égal au nombre de moles du produit. Le
nombre total de moles reste constant. Une élévation de pression, à
température constante, n'a pas d'influence sur l'équilibre (1). Réponse C.
41.
Indiquer l'influence de l'ajout d'une quantité élémentaire de
dihydrogène sur l'équilibre (1), à température fixée.
L'excès d'un réactif déplace l'équilibre dans le sens direct, formation
de HI. Réponse A.
42. L'enthalpie
standard de la réaction (1) est DrH°
=-13,05 kJ mol-1, supposée indépendante de la
température. Indiquer l'influence de la température sur l'équilibre
chimique (1).
Une réaction exothermique ( DrH°
< 0 ) est favorisée par une diminution de la température. Réponse B.
|
|
|
|
Réactions
en solution aqueuse.
Solubilité
du diiode dans l'eau selon l'équilibre :
I2(s) = I2 aq. Ks
= 1,3 10-3.
43. La solubilité
molaire volumique du diiode dans l'eau est :
Ks = [ I2
aq]
=1,3 10-3 mol/L. Réponse B.
Solubilité du diiode dans une
solution d'iodure de potassium de concentration c0.
44.
La dissolution du diiode dans une solution d'iodure de potassium
conduit à un équilibre de complexation :
I2aq +I-aq = I3-aq. Kf
= [I3-aq]
/ ([I-aq]
[I2aq]).
La valeur approximative de la constante de formation du
complexe I3-aq est :
E°(
I2aq /I3-aq)
=0,79 V ; E°( I2aq
/ I-aq) =0,62 V ; E°(I3-aq/ I-aq)=0,54 V.
3
I2aq + 2e-=2 I3-aq.
E1 =E°(
I2aq /I3-aq)
+0,03 log([
I2aq]3
/ [I3-aq]2).
I2aq
+2e- = 2 I-aq. E2
=E°( I2aq
/ I-aq) +0,03 log ([I2aq]) /[I-aq]2
).
A l'équilibre : E1
=E2.
E°(
I2aq /I3-aq)
+0,03 log([
I2aq]3
/ [I3-aq]2)=
E°( I2aq
/ I-aq) +0,03 log ([I2aq]) /[I-aq]2
).
E°(
I2aq /I3-aq)
-E°( I2aq
/ I-aq) =0,03 log (
[I3-aq]2 / [I-aq]2
[I2aq]2).
E°(
I2aq /I3-aq)
-E°( I2aq
/ I-aq) =0,03 log Kf2.
(0,79-0,62) /0,06= log Kf. Kf =6,8 102. Réponse B.
45. La solubilité
molaire volumique du diiode dans un litre de solution d'iodure de
potassium KI de concentration c0 = 0,1 mol/L est
:
|
Avancement
volumique ( mol / L) |
I2aq |
+I-aq |
= I3-aq |
| initial |
0 |
a |
c0 |
0 |
| à
l'équilibre |
x |
a-x |
c0-x |
x |
s = [I3-aq]
+[I2aq] ~ [I3-aq] =Kf [I-aq]
[I2aq] =Kf
Ks (c0-x) =x.
x =680*1,3 10-3(0,1-x) =0,0884 -0,884 x; x = 4,7 10-2 mol/L. Réponse C.
46.
Le pH d'une solution aqueuse de HIO3, de concentration 0,01 mol/L est :
(pKa(HIO3 / IO3-)
=0,8 ).
pH =½( pKa - log 0,01)=
1,4. Réponse B.
Oxydation des ions iodates.
La réaction d'oxydoréduction des ions iodures par les ions
peroxodisulfates en solution aqueuse a pour équation bilan (2) :
S2O62-
aq +2I-aq = 2 SO42-aq
+ I2aq. Constante d'équilibre K =[SO42-aq]2[I2aq] / ([
S2O62-
aq][I-aq]2).
E°( I2aq / I-aq) =0,62 V
; E°(S2O62-
aq / SO42-aq) =2,01 V.
47.
La valeur approximative de K est :
S2O62-
aq +2e- =2 SO42-aq ; E1 =E°(S2O62-
aq / SO42-aq)+ 0,03 log ( [
S2O62-
aq] /[SO42-aq]2 ) .
I2aq +2e- =2I-aq ; E2 =
E°( I2aq / I-aq) +0,03 log([ I2aq] / [I-aq]2 ).
A l'quilibre E1 =E2.
E°(S2O62-
aq / SO42-aq)+ 0,03 log ( [
S2O62-
aq] /[SO42-aq]2 )=
E°( I2aq / I-aq) +0,03 log([ I2aq] / [I-aq]2 ).
E°(S2O62-
aq / SO42-aq)-
E°( I2aq / I-aq) =0,03 log ([ I2aq] [SO42-aq]2/ ([I-aq]2[
S2O62-
aq]) )=0,03 log K.
log K = (2,01-0,62) /0,03 = 46,3 ; K = 2,1 1046. Réponse D.
48. Pour la réaction (2) choisir la conclusion la plus correcte.
La réaction (2) est totale, mais on ne peut pas conclure si elle est rapide. Réponse D.
|
|
|
.
Cinétique chimique.
On étudie la cinétique de la réaction (2) suivie par spectrophotométrie.
49.
Seul le diiode est coloré. précisez sa couleur.
La solution aqueuse de diiode est brune. Réponse C.
On
mesure l'absorbanceau cours du temps de la solution. l'ordre partiel
par rapport aux ions iodures est p et l'ordre partiel par rapport aux
ions peroxodisulfates est n.
A
l'instant t=0, on mélange 25 mL de solution d'iodure de potassium à
0,250 mol/L et 15 mL de solution de peroxodisulfate d'ammonium à 6,25 10-3 mol/L.
50.
Les paramètres expérimentaux permettent de déterminer l'ordre partiel
par rapport à l'ion peroxodisulfate ( l'ion iodure est en large excès
). Réponse C.
51.
La concentration en ion peroxodisulfate à un instant t est liée à la
concentration en diode à ce même instant par la relation :
[
S2O62-
aq]0 - [
S2O62-
aq]t = [ I2aq] t. Réponse C.
52. On suppose que n = 1. A étant l'absorbance de la solution à la date t et A0 étant l'absorbance initiale, la fonction qu'il faut tracer pour vérifier cette hypothèse est :
ln( A / A0) = f(t) avec A = e l [I2] = e l ([
S2O62-
aq]0 - [
S2O62-
aq]t ).
A0 = e l [I2]infini = e l[
S2O62-
aq]0 .
ln( A / A0) =ln (1-[
S2O62-
aq]t /[
S2O62-
aq]0 ).
53. On aurait pu suivre l'évolution de la réaction (2) au cours du temps grâce à un dosage volumétrique de I2 par le thiosulfate. La détection de l'équivalence se fait par un indicateur coloré, l'mpois d'amidon. Réponse B.
Chimie organique.
54. La molécule 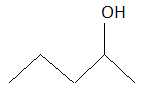 est un alcool secondaire. Réponse B. est un alcool secondaire. Réponse B.
55. La molécule 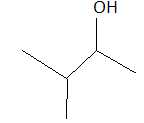 se nomme 3-méthylbutan-2-ol. Réponse C. se nomme 3-méthylbutan-2-ol. Réponse C.
56. Une distillation fractionnée permet de séparer deux liquides miscibles qui ont des températures d'ébullition différentes. Réponse B.
57. La réaction (CH3)2C=CH2 +H2O --> (CH3)2COH-CH3 est une réaction d'addition d'eau sur un alcène. Réponse C. |
|