Pile à combustible
du voilier Acciona. Concours Caplp maths sciences 2015.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
L'énergie
produite est essentiellement stockée dans les batteries lithium-ion.
Donner un avantage des batteries Li-ion par rapport aux batteries
clasiques au plomb.
La densité
massique des batteries Li-ion ( 15 à 200 Wh / kg ) est bien supérieure
à la densité massique des batteries au plomb( 30 Wh / kg ). Or
sur un voilier la masse et le volume des batteries doivent être le plus
faible possible, à énergie stockée égale.
Les batteriesLi-ion sont assemblées par paire, chaque paire étant constituées de deux batteries associés en série. Quelle est la tension aux bornes de chaque paire et la capacité nominale correspondante ?
En série, les tensions nominales s'ajoutent : 24+24 = 48 V. L'intensité
étant identique en tout point d'un montage série, la capacité nominale
de l'association reste égale à celle d'une batterie, soit 160 Ah.
Les besoins du bateau en énergie électrique sont estimés au maximum à
7200 Wh par jour. En supposant que l'on ne puisse plus recharger les
batteries par tous les dispositifs existants, calculer l'autonomie de
ce parc de batterie Li-ion composé de trois paires de batteries. On
suppose que les batteries peuvent être décharger totalement.
Capacité nominale des trois paires de batteries : 3 * 160 = 480 Ah.
Tension aux bornes de chaque paire : 48 V.
Energie disponible : 48*480 =2,3 104 Wh.
Autonomie : 2,3 104 / 7200 =3,2 jours.
Comment entamer l'apprentissage du principe d'un accumulateur au plomb ?
- Quelle est la différence entre une pile et un accumulateur ?
- Quelle est la différence entre les métaux d'une pile et ceux d'un accumulateur au plomb ?
- Schématiser deux montages permettant de réaliser un accumulateur au plomb en charge et en décharge.
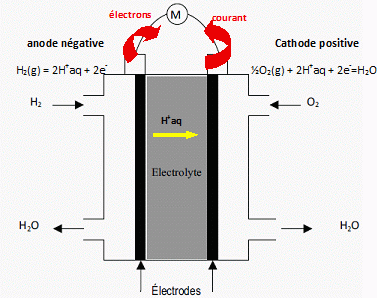
Pile à combustible.
Expliquer en quelques lignes le fonctionnement de la pile à
combustible. Ecrire les équations et le nom des réactions qui ont lieu
à l'anode et à la cathode ainsi que l'équation bilan de son
fonctionnement. Préciser le rôle de l'électrolyte.
Une
pile à combustible permet de convertir directement une énergie chimique
en énergie électrique par une réaction d'oxydoréduction. La pile fonctionne avec une membrane à polymère échangeuse d'ions
oxonium.
L'électrolyte est une membrane polymère de type acide. Les ions
négatifs sont retenus dans la structure de la membrane alors que seuls
les ions H+
sont mobiles de l'anode vers la cathode. La membrane doit
empécher les gaz ( le dihydrogène qui est très petit, le diazote
et le dioxygène) de se mélanger. Les électrons ne doivent pas être
capables de traverser la membrane. La membrane doit être correctement
hydratée ( trop sèche, elle peut se rompre).L'équation
chimique mise en jeu dans le fonctionnement de la pile est : 2H2(g) + O2(g) = 2H2O(l).
Etablir la relation reliant la quantité de matière de dihydrogène nc, l'intensité débité I et la durée Dt de fonctionnement d'une cellule élémentaire.
Quantité de matière ( mol) d'électrons : n(e-) = 2 nC ;
charge d'une mole d'électron : NA e ;
Quantité de matière d'électricité Q = IDt = n(e-)NA e = 2 nCNA e ;
nC= IDt / (2 NA e).
Les cellules élémentaires sont connectées en série du point de vue
électrique ( en parallèle La pile débite une puissance maximale durant
une durée de 6 heurs 46 minutes. du point de vue hydraulique ).
Déterminer l'expression de la quantité de dihydrogène totale ntot(H2) effectivement consommé et en déduire la masse de dihydrogène correspondante lorsque la pile débite à puissance maximale.
Pmax = 2500 W ; Imax = 52,5 A ; tension de sortie nominale 48 V ; 70 cellules élémentaires ; débit de H2 à puissance maximale sous un bar à 20°C : 30 L / min.
6 h 46 min =24360 s.
ntot(H2) = 70 IDt / (2 NA e) =70*52,5*24360 /(2*6,02 1023*1,6 10-19)=464,7 ~465 mol.
m(H2) =M(H2) ntot(H2) =2,0 *464,7 ~630 g ~0,93 kg.
Ce résultat est cohérent avec la masse de dihydrogène embarqué ( 1,0 kg ).
Quels sont les risques en cas de surchauffe du système ?
Le polymère de la membrane peut brûler et rompre.
Une fatigue du polymère
peut produire un court-circuit pneumatique entre l'oxydant et le
dihydrogène ( inflammation, risque d'explosion ).
Dans le cas de la pile étudiée, le polymère est le Nafion. La chaîne du
polymère est constituée d'une colonne vertébrale ne contenant que des
groupes CFn sur laquelle sont fixés des groupement d'acide sulfonique H2SO3.
Donner les configurations électroniques du carbone, du fluor, de
l'hydrogène et du soufre. Ecrire la structure de Lewis du
tétrafluoroéthène et de l'acide sulfonique.
H : 1 s1 ; C : 1s2 2s2 2p2 ; O : 1s2 2s2 2p4 ; F : 1s2 2s2 2p5 ; S : 1s2 2s2 2p6 3s2 3p4.
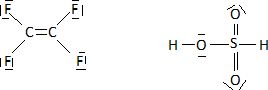
La molécule de Nafion est amphiphile, c'est à dire qu'elle
possède à la fois des groupemens hydrophiles et hydrophobes. Indiquer
sur le schéma la position de ces deux groupements en justifiant.
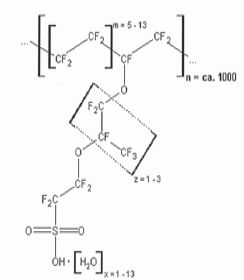
Les groupes polaire SO3H sont hydrophiles, amis de l'eau, molécule polaire.
La structure en CFn est apolaire, hydrophobe.
|
| .
. |
|
|
Durée d'autonomie d'une pile à combustible.
Définir "gaz parfait".
Un gaz parfait est un modèle thermodynamique dans lequel les interactions entre molécules sont négligeables. Un
gaz réel se comporte comme un gaz parfait à pression très faible,
quelque soit la température, ou bien à basse pression et haute
température.
Rédiger une correction de l'exercice suivant.
Le
principe de cette pile est le suivant : une réaction électrochimique
contrôlée, entre du dioxygène de l'air et du dihydrogène, génère
simultanément de l'électricité, de l'eau et de la chaleur.
La pile à combustible du voilier est constituée de 70 cellules
élémentaires associées en série. Lorsque la puissance débitée est
maximale, le courant électrique circulant dans les cellules
élémentaires est constant, d'intensité I = 52,5 A.
La réaction s'opère au sein de chaque cellule élémentaire composée de
deux électrodes séparées par une membrane polymère échangeuse de
protons H+ qui joue le rôle d'électrolyte. Le dihydrogène
est stockée à bord sous forme de gaz comprimé à la pression de 300
bars. La masse du dihydrogène disponible est m = 1,0 kg. L'équation
chimique mise en jeu dans le fonctionnement de la pile est : 2H2(g) + O2(g) = 2H2O(l).
Calculer la quantité de matière de dihydrogène disponible.
n = m / M(H2) = 1,0 103 / 2,0 = 5,0 102 moles.
Calculer le volume de dihydrogène V0, pris à la température de 20°C sous une pression de 1,0 bar, qu'il a fallu comprimer pour remplir le réservoir.
Loi des gaz parfaits : V0 = n RT / P avec T = 273+20 = 293 K et P = 1,01 105 Pa.
V0 =5,0 102 *8,314 *293 /(1,01 105) = 12,0594 ~12 m3.
Lorsque la puissance débitée est maximale, le débit de dihydrogène à la
pression de 1 bar et à la température de 20°C est égal à Q = 30 L min-1. En déduire la durée de fonctionnement de la pile à pleine puissance.
Dt = V0 / Q = 12,0594 / 0,030 ~402 minutes ou 6,70 h soit 6 h 42 min.
Déterminer l'énergie disponible avec cette pile sachant que la puissance maximale débitée est égale à 2500 W.
Pmax * durée ( heure) = 2500 *6,70 = 1,6749 104~1,68 104 Wh.
En déduire le nombre de jours d'autonomie du voilier sachant que les besoins hebdomadaires en énergie sont de 7200 Wh.
1,6749 104 / 7200 =2,33 jours.
|
|
|
Un
élève remarque : " Vous vous êtes trompé dans l'énoncé, ce serait pas
plutôt une intensité de 0,75 A par cellule ? Sinon si on prend un "
coup" de jus, avec 52,5 A, on est mort ".
Analyser les raisons de cette remarque et expliquer brièvement les conceptions mises en jeu au travers de celle-ci.
La tension caractérise le
générateur. L'intensité caractérise le courant électrique. La valeur de
l'intensité dépend à la fois du générateur et de la résistance
électrique du récepteur ( évaluée à 5000 ohm pour le corps humain sec
). Une électrisation est le fait que le courant traverse le corps
humain. Les séquelles d'une électrisation dépendent de l'intensité du
courant et de la durée de son passage. La fibrilation ventriculaire,
cause principale de mort par choc électrique, intervient pour un
courant d'intensité 75 mA traversant le coeur pendant une seconde.
52,5 A est l'intensité du courant circulant dans les cellules élémentaires. Tension de sortie nominale : 48 V.
Intensité traversant le corps humain sec : 48 / 5000 ~1 mA. Le seuil de perception est tout juste atteint.
Un
kilogramme de dihydrogène peut libérer une énergie maximale de 120 MJ
environ. Montrer que le rendement de la pile à combustible est
d'environ 50 %. Quelle est la nature de l'énergie convertie en nature
non électrique.
Energie disponible pour cette pile :1,68 104 Wh ou 1,68 104*3600 =6,0 107 J = 60 MJ.
Rendement 60 / 120 ~0,50 ou 50 %. Une partie de l'énergie libérée par le dihydrogène est convertie en énergie thermique.
L'essence contient essentiellement de l'octane C8H18. Ecrire l'équation de conbustion complète de l'octane.
C8H18 + 12,5O2 ---> 8 CO2 + 9 H2O.
Le rendement d'un moteur thermique est de l'ordre de 25 % Le pouvoir calorifique moyen de l'essence est ègal à 47,3 MJ kg-1.
Calculer la masse d'essence qu'il faut brûler dans un moteur thermique
pour libérer la même quantité d'énergie que la pile à combustible
étudiée ci-dessus.
La pile à combustible libère 60 MJ kg-1 d'énergie utile.
L'essence libère 47,3 *0,25 ~12 MJ kg-1 d'énergie utile. 5 kg d'essence sont donc nécessaire.
|
|