Chimie organique ;
principe du pHmètre. Bts Métiers de l'eau 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
4. Chimie
organique
4.1 - Citer le nom
général donné aux maladies engendrées par une intoxication au mercure.
Hydrargyrisme.
4.2- On s’intéresse
à la synthèse de l’acétaldéhyde.
4.2.1- Dans la
nomenclature officielle, donner le nom de l’acétaldéhyde.
Ethanal.
4.2.2- Préciser à
quelle famille de composés organiques il appartient.
Aldehyde.
4.2.3- Indiquer
comment est mise en évidence la présence d’acétaldéhyde dans un milieu
réactionnel.
En présence d'un aldehyde, la liqueur de Fehling donne, à chaud, un
précipité rouge brique d'oxyde de cuivre (I).
4.2.4- Écrire
l’équation de la réaction de synthèse de l’acétaldéhyde à partir de
l’éthène et de dioxygène.
CH2=CH2 + ½O2 --> CH3-CHO.
4.2.5- Rappeler le
rôle du catalyseur.
Préciser s’il s’agit d’une catalyse homogène ou hétérogène. Justifier
la réponse.
Un catalyseur accélère une réaction chimique thermodynamiquement
possible. Il participe à la réaction et se trouve régénéré lors de la
dernière étape. Si deux issues sont possibles, il peut orienter la
réaction.
HgO est un solide, l'éthène est gazeux : la catalyse est hétérogène.
4.2.6- On peut
synthétiser l’acétaldéhyde par oxydation de l’éthanol, ce dernier
pouvant être obtenu par addition d’eau sur l’éthène. Écrire l’équation
de la synthèse de l’éthanol à partir de l’éthène en milieu acide.
CH2=CH2 +H2O
--> CH3-CH2OH.
On s’intéresse à la synthèse
d’alcools à partir du but-1-ène.
4.3.1- Écrire la
formule semi-développée du but-1-ène.
CH3-CH2-CH=CH2.
4.3.2- On réalise
l’addition d’eau sur le but-1-ène.
Écrire la formule semi-développée du produit qui se forme
majoritairement et le nommer.
4.3.3- Écrire la
formule semi-développée du produit minoritaire et le nommer.
La
règle de Markovnikov permet de prévoir sur quel atome de carbone se
fixe l'hydrogène de l'hydracide ( ou de H2O)
: l'atome d'hydrogène se fixe sur l'atome de carbone le moins substitué
( formation du carbocation le plus stable ).
Le butan-2-ol est majoritaire. CH3-CH2-CH(OH)-CH3.
Le butan-1-ol est minnoritaire.
CH3-CH2-CH2-CH2OH.
|
| .
. |
|
|
Principe de fonctionnement du pHmètre.
Pour effectuer une mesure de pH, on plonge une électrode de verre ainsi
qu’une électrode de
référence dans la solution à analyser.
L’ensemble constitue une pile dont on mesure la force électromotrice
(f.é.m) E qui dépend de la
concentration des ions oxonium H3O+ dans la solution.
Cette mesure de la f.é.m. s’effectue à l’aide d’un voltmètre numérique
de grande impédance
d’entrée qui donne par lecture directe la valeur du pH.
1- Étude du 1er étage – Le capteur de pH
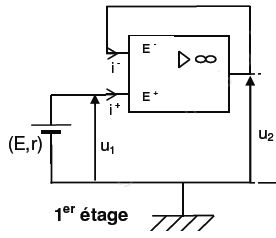
1.1- Pour un AOP idéal, rappeler les propriétés relatives :
1.1.1- aux courants d’entrée i- et i+ .
Les intensités des courants d'entrée sont nulles.
1.1.2- à la tension différentielle d’entrée notée e avec e = UE+E– .
En régime linéaire, la tension différentielle est nulle.
1.2- À l’aide de la loi des mailles, montrer que : u2 = u1.
Un simple fil relie l'entrée inverseuse et la sortie de l'A.O et e =0.
En conséquence u2 = u1.
1.3- Préciser alors le nom donné à ce montage.
Montage suiveur.
|
|
|
|
2- Étude du 2ème étage – Montage amplificateur inverseur.
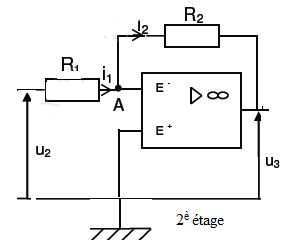
2.1- Écrire la loi des noeuds au point A.
i1 = i-+i2 avec i-=0.
2.2- En déduire la relation liant les courants i1 et i2.
i1 =i2.
2.3- En utilisant la loi des mailles, déterminer la relation liant u3 à u2, R1 et R2.
u2 =R1i1, E- et E+ jouent le rôle de masse virtuelle.
R2i2+U3=0 avec i1 =i2 =u2 /R1.
R2u2 /R1+U3=0 ; u3=-R2 /R1 u2.
2.4- Justifier alors le nom donné à ce 2ème étage.
Le signe de la tension change et u2 est amplifiée d'un facteur R2 /R1.
Étude du 3ème étage.
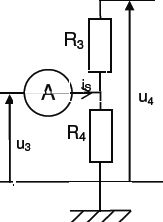
Écrire la relation liant u4 à u3, R3 et R4. On suppose que l’intensité de sortie iS est nulle.
On note i l'intensité dans R3 et R4.
u3 = R4 i ; u4 =(R3+ R4 )i ; u4 =(R3+ R4 )/R4 u3.
4- Échelle de pH – Échelle de tension.
4.1- Établir la relation entre u4 et E.
u2 = u1=E ; u3=-R2 /R1 u2 = -R2 /R1 E ; u4 = -(R3+ R4 )/R4 R2 /R1 E.
4.2- L’étalonnage donné par le constructeur est : E = 0,406 – 0,058 × pH.
Donner les limites de l’échelle de tension correspondant aux limites de l’échelle de pH à 25°C en solution aqueuse.
pH=0 : E = 0,406 V.
pH=14 ; E = 0,406-0,058 *14= -0,406.
|
|
|
|