L'huile
d'olive, matière première et aliment. Bac
S Amérique du Nord 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
De l'huile d'olive au savon.
Le
savon de Marseille est fabriqué à partir d'huile d'olive et de
soude ; ce savon est constitué d'oléate de sodium. le protocole de
synthèse au laboratoire est décrit ci-dessous :
- verser 13,6 g d'huile d'olive ( oléine) et 20 mL d'éthanol dans un ballon ;
- ajouter 20 mL de soude à 10 mol/L ( en excès) ;
- chauffer à reflux le mélange réactionnel pendant 15 min ;
-
verser le mélange obtenu dans un becher contenant 100 ml de solution
aqueuse de chlorure de sodium : le précipité obtenu est l'oléate de
sodium.
Equation de la réaction de synthèse de l'oléate de sodium.
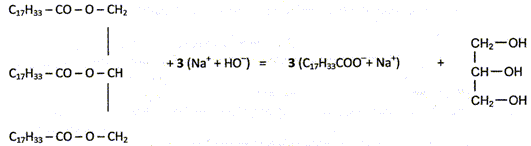
A quelle famille de fonction appartiennent les triglycérides d'acides gras ( TAG)
Les TAG sont des triesters du glycérol.
Compléter le protocole avec les étapes permettant d'obtenir un "pain" de savon utilisable en cosmétique.
Filtration
sous vide et lavages avec de l'eau froide saturée de chlorure de
sodium jusqu'à ce que le filtrat ne soit plus basique.
Sécher le savon.
Chauffer
le savon au bain marie, y incorporer un ester parfumé ; lorsque le
savon est suffisamment maléable, le couler dans un moule. Laisser
refroidir.
Quel est le rendement de la synthèse sachant que 6,6 g de savon ont été obtenu ?
Moléine = 884 g/mol. Msavon = 304 g/mol.
Quantité de matière d'oléine, réactif en défaut : n =13,6 / 884 = 1,538 10-2 mol.
Quantité de matière de savon : 3n = 4,615 10-2 mol.
Masse maximale de savon : 4,615 10-2 *304 = 14,0 g.
Rendement : masse expérimentale / masse maximale = 6,6 /14 = 0,47 ( 47 %).
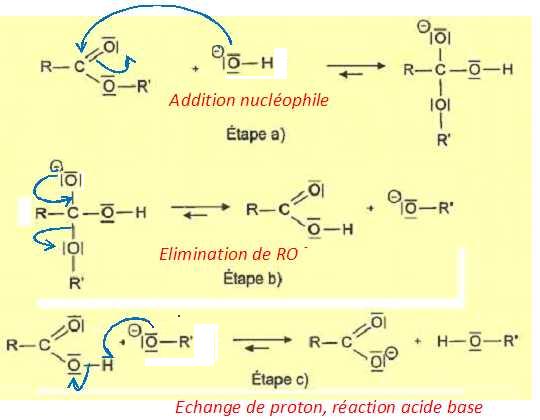
Un
mécanisme simplifié de la réaction de synthèse est proposé.
Représenterles flèches courbes rendant compte du mécanisme des trois
étapes. Justifier l'orientation de ces flèches.
Pour chaque étape, indiquer le type de réaction.
Les flèches sont orientées du site nucléophile ( riche en électrons) vers le site électrophile ( déficitaire en électrons).
|
| .
. |
|
|
|
.
|
|
Le technicien de laboratoire cherche à déterminer la catégorie d'une huile d'olive. Il effectue les opérations suivantes :
Dans un erlenmeyer de 250 mL , il verse un volume Véthanol = 40 ±1 mL d'éthanol et un volume Vether = 40 ± 1 mL d'éther éthylique. Ce mélange sert de solvant.
Il ajoute dans l'erlenmeyer Vhuile = 20,0 ±0,1 mL d'huile d'olive puis quelques gouttes d'indicateur coloré. Il agite pour homogénéiser.
Il ajoute progressivement au mélange contenu dans l'erlenmeyer une solution S de potasse alcoolique de concentration molaire Cb = (1,00 ±0,02) 10-1 mol/L, contenue dans une burette.
Il observe un virage de l'indicateur coloré pour un volume VE = 10,4 ± 0,1 mL de solution S.
Pourquoi utilise-t-il un mélange d'éthanol et d'éther ?
L'huile d'olive est miscible dans un mélange éthanol éther éthylique alors qu'elle est insoluble dans l'eau.
Les volumes d'huile et d'éthanol sont-ils prélevés avec la même verrerie ? Justifier.
Le volume d'huile est très précis, il sera prélevé à l'aide d'une pipette jaugée de 20,00 mL.
Le volume d'éthanol est peu précis, une éprouvette graduée est suffisante.
Le technicien doit-il prendre des mesures de précautions particulières ?
L'hydroxyde de potassium est caustique : port d'une blouse, de gants et lunettes de protection.
Quelle type d'analyse le technicien a-t-il mis en oeuvre ?
Contrôle de qualité, titrage de l'acide oléïque présent dans l'huile d'olive par une base, l'hydroxyde de potassium.
RCOOH + OH- ---> RCOO- + H2O.
Déterminer la masse m d'acide oléique contenu dans le volume d'huile prélevé. M acide oléïque = 282 g/mol.
Masse volumique de l'hule d'olive r = 0,92 g/L.
A l'équivalence : quantité de matière d'ion hydroxyde = quantité de matière d'acide oléïque = n = Cb VE = 0,100 *10,4 10-3 =1,04 10-3 mol.
m = n M acide oléïque =1,04 10-3 *282 =0,29328 ~0,293 g ( 293 mg) dans 20,0 mL d'huile d'olive.
Masse de 20,0 mL d'huile d'olive : 20,0 *0,92 = 18,4 g.
Pourcentage massique d'acide oléïque dans cette huile : 0,293 /18,4 *100 ~1,6 %.
Ce taux d'aciciité correspond à une huile d'olive vierge.
Donner un encadrement de m.
[U(m) / m]2 =[U(VE) / VE]2 +[U(Cb) / Cb]2 =(0,1 / 10,4)2 + 0,022=4,9 10-4 ;
U(m) / m =2,2 10-2 ; U(m) =0,293 *2,2 10-2 =6,5 10-3 g ~7 mg.
m = (293 ±7) mg.
|
|