Dépollution
des eaux. Bac S Centres étrangers 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Les métaux lourds tels que le cuivre, le cobalt ou le nickel peuvent se retrouver dans les eaux usées.
Leur
présence est dangereuse pour l’homme ; ils sont toxiques à faible
concentration et s’accumulent dans l’organisme. On cherche des procédés
permettant de dépolluer les eaux en métaux lourds. Une piste
prometteuse utilise le chitosane, molécule synthétisée à partir de la
chitine elle-même extraite des carapaces de crustacés (crevette, crabe,
homard…). Le chitosane s’associe aux ions métalliques pour former une
nouvelle espèce chimique insoluble dans le milieu, que l’on isole par
filtration.
On souhaite tester, en laboratoire, les propriétés du
chitosane sur trois eaux polluées artificiellement
respectivement au cuivre, au nickel et au cobalt.
Voici les étapes du protocole opératoire.
Étape 1 : Préparation des trois solutions.
Trois solutions aqueuses d'ions métalliques de volume V0 = 40,0 mL et de concentration molaire C0 sont versées dans trois béchers :
- Solution S1 de sulfate de cuivre II (Cu2+ + SO42-) de couleur bleue ;
- Solution S2 de sulfate de nickel II (Ni2+ + SO42-) de couleur verte ;
- Solution S3 de sulfate de cobalt II (Co2+ + SO42-) de couleur rose.
Étape 2 : Analyse spectrale des trois solutions.
On mesure à l'aide d'un spectrophotomètre l’absorbance A0(1), A0(2) et A0(3) des solutions S1, S2 et S3.
Étape 3 : Solubilisation du chitosane.
On ajoute une même masse m de chitosane solide dans les trois béchers. On agite pendant trente minutes.
Étape 4 : Filtration.
On filtre les trois solutions et on récupère les filtrats d’aspect limpide.
Étape 5 : Nouvelle analyse spectrale.
On mesure l’absorbance A(1), A(2) et A(3) des filtrats dans la gamme de longueurs d’onde
400 - 900 nm.
L’étude est réalisée pour 40,0 mL de solution aqueuse à la même concentration molaire C0 et
différentes
masses m de chitosane solide. Les résultats obtenus sont exploités et
conduisent aux tracés des graphes représentant l’évolution du rapport
A/A0 (exprimé en pourcentage) en fonction de la masse de chitosane ajoutée.
|
| .
. |
|
|
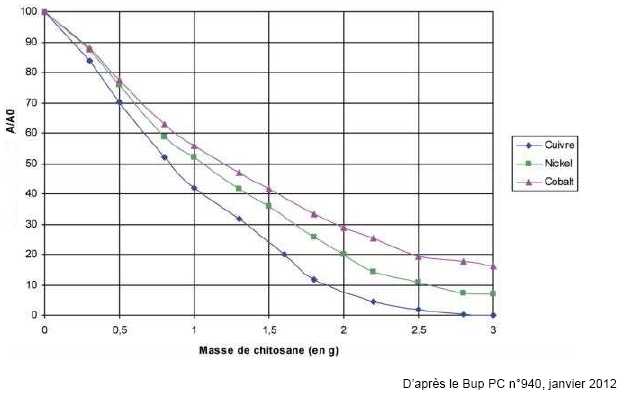
On dispose de 60 g de carapaces de crevettes. Cette masse de carapaces est-elle suffisante pour
ramener 40 mL de la solution S1
aux normes environnementales françaises de pollution des eaux en cuivre
? Si non, quelle est la masse minimale de carapaces de crevettes
nécessaires pour éliminer le cuivre de la solution ?
Données : masses molaires M(Co) = 58,9 g/ mol ; M(Cu) = 63,5 g/ mol ; M(Ni) = 58,7 g/mol.
|
.
|
|
Normes environnementales françaises de pollution des eaux en cuivre : inférieure ou égale à 0,5 mg/ L ;
soit C = 0,5 10-3 / 63,5 ~8 10-6 mol / L d'élément cuivre.
Coefficient directeur de la droite ci-dessous : k = 1,26 / 0,10 = 12,6 L mol-1.
A = k C = 12,6 *8 10-6 ~1 10-4.
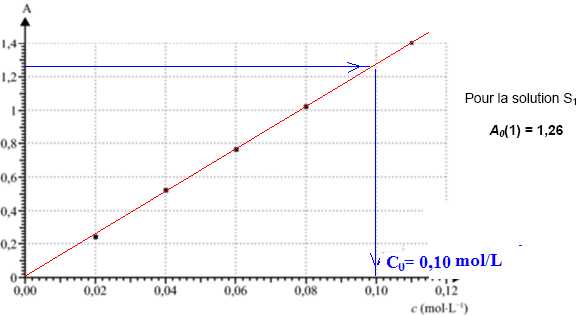
A / A0 ~1 10-4 / 0,1 ~1 10-3 ( 0,1 %).
Quantité de matière d'ion cuivre (II) dans 40 mL de solution 1 : 0,10 *0,040 = 4,0 mmol.
Masse d'élément cuivre : 4,0 *M(Cu) = 4,0 *63,5 =254 mg.
D'après
le graphe ci-dessus, 2,8 g de chitosane permettent d'éliminer tout le
cuivre de 40 mL de solution à 0,10 mol/L, soit 254 mg.
100 g de carapace de crevettes permettent d'obtenir 4 g de chitosane.
2,8 g de chitosane sont obtenus à partir de 2,8 /4 *100 =70 g de carapace.
60 g de carapaces ne suffisent pas, il en faut au minimum 70.
|
|