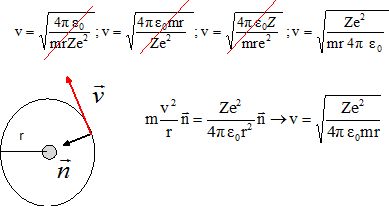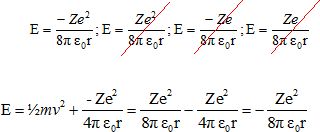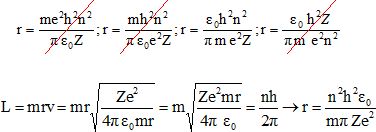|
A
une particule est associée une fonction d'onde dont l'amplitude dépend
des coordonnées d'espace et de temps de cette particule. Un triplet de
trois nombre quantiques ( n, l, m) caractérise la fonction d'onde.
Les valeurs possibles de l et m sont :
l appartient à [0 ; n-1] et m appartient à [-l ; +l] ; vrai.
l = n-1 et m appartient à [-l ; +l] ; faux.
l appartient à [0 ; n] et m appartient à [0 ; l-1] ; faux.
l appartient à [0 ; 2n] et m appartient à [-2l ; 2l] ; faux.
Le triplet (n, l, m) qui est possible est :
n=3 ; l=2 ; m=0 ; vrai.
n=2 ; l=2 ; m=-1 ; faux.
n=3 ; l=0 ; m=3 ; faux.
n=3 ; l=-2 ; m=0 ; faux.
Le symbole 1p caractérise une orbitale atomique. Faux.
Le symbole 3f caractérise une orbitale atomique. Faux.
Le symbole 5g caractérise une orbitale atomique. Vrai.
Le symbole 4s caractérise une orbitale atomique. Vrai.
La configuration électronique qui respecte le principe de Pauli est :
1s2 2s2 2p7. Faux.
1s2 2s2 2p6 3s2 3p6 3d12 4s2. Faux.
1s2 2s2 2p6 3s3 . Faux.
1s2 2s2 2p6 3s2 3p6 . Vrai.
|