Chimie organique.
Concours technicien 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Chimie organique.
La réaction de Cannizzaro consiste en la formation d’un alcool et d’un
carboxylate à partir de deux aldehydes et l'action de la soude.
Parmi les propositions suivantes, laquelle ( lesquelles ) est (sont)
exacte(s) concernant le benzaldeyde de formule topologique :
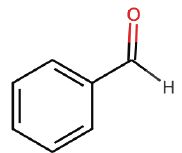
Sa nomenclature selon les règles de l'IUPAC est : aldehyde benzoïque.
Vrai.
Sa
nomenclature selon les règles de l'IUPAC est :1-cyclohéxanal. Faux.
Sa formule brute est C7H5O. Faux. C7H6O.
Sa formule
brute est C8H6O. Faux.
Le benzaldehyde est chiral. Faux.
Le benzaldehyde est aromatique. Vrai.
Le benzaldehyde possède une odeur de cannelle. Faux . Odeur d'amande amer.
Le
benzaldehyde possède une odeur d'amande. Vrai.
Le benzaldehyde possède un atome de carbone asymétrique. Faux.
Le benzaldehyde est corrosif. Faux.
Proposer une
équation bilan pour la réaction de Cannizaro du benzaldehyde.
2 C6H5-CHO + HO- -->C6H5-CH2OH
+C6H5-COO-.
Alcool benzylique et ion benzoate.
La réaction de Cannizzaro est considérée comme une dismutation des
aldehydes.
Justifier
cette affirmation.
Degré d'oxydation de l'atome de carbone fonctionnel dans :
le benzaldehyde : 0 ; l'alcool benzylique : -2 ; ion benzoate +2.
Une
molécule de benzaldehyde s'oxyde en ion benzoate( le degré d'oxydation
du carbone augmente de 2 ) tandis qu'une autre molécule se réduit en
alcool benzylique.( le degré d'oxydation du carbone diminue de 2).
Proposer
trois tests caractéristiques pour vérifier la présence d'aldehyde et un
test pour vérifier la présence d'alcool.
Un aldehyde donne :
un précipité rouge brique en présence de liquer de Fehling ; un dépôt
d'argent en présence de nitrate d'argent ammoniacal ; une coloration
rose en présence du réactif de Schiff.
Un alcool primaire décolore une solution acide de permanganate de
potassium.
Proposer 4 méthodes
de caractérisation de l'huile obtenue après traitement de la phase
organique.
L'huile obtenue est constituée par l'alcool benzylique.
IR, chromatographie, spectrographie de masse, RMN du proton.
Proposer 4 méthodes
de caractérisation de l'huile obtenue après traitement de la phase
aqueuse.
Le solide est l'acide benzoïque.
IR, chromatographie,
spectrographie de masse, mesure de la température de fusion.
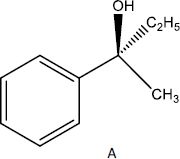
On peut obtenir à partir du benzaldehyde par une suite d'étapes la
molécule A suivante :
|
| .
. |
|
|
Proposer
un ( des) alcène(s) permettant de préparer cette molécule par une
réaction d'hydratation.
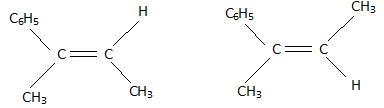
Parmi
les propositions suivantes laquelle ( lesquelles) est ( sont) exacte(s)
concernant le produit A :
La
molécule A est chirale de configuration R. Vrai.
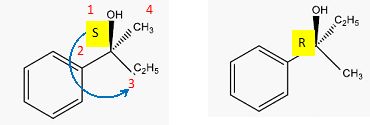
La molécule A est chirale
de configuration S. Faux.
Une molécule ne possèdant qu'un atome de carbone asymétrique est
chirale. Vrai.
Une molécule ne possèdant
pas d'atome de carbone asymétrique est achirale. Faux.
Une molécule de configuration R est dextrogyre. Faux.
Identifier les
différentes étapes du protocole.
Etape 1 :
préparation d'une solution de soude.
Etape 10 :
précipitation de l'acide benzoïque.
Etape 6 :
séchage de la phase organique.
Etape 12 :
recristallisation.
Etape 5 :
extractions par l'éther éthylique..
Etape 8 :
évaporation du solvant.
Etape 3 :
chauffage à reflux.
Etape 7 :
filtration.
Proposer
une liste de matériel pour réaliser cette expérience.
Erlenmeyer,
bain de glace, agitateur magnétique chauffant, ballon de 50
mL, réfrigérant à eau, ampoule à décanter, évaporateur rotatif, bechers.
|
.
|
|
A 25°C le pH d'une solution d'eau pure est égal à 7.
Convertir
25°C en K et 1 bar en pascal.
T = 273+25 = 298 K et P ~105 Pa.
Dans les conditions normales de température et de pression on souhaite
connaître la densité du dichlore gazeux.
Quelle
formule utilisez-vous ? M = 29 d ; d = M/29 = 71 / 29 = 2,45.
Le
dichlore est-il plus lourd ou plus leger que l'air ? Justifier.
Un gaz dont la densité est supérieure à 1 est plus lourd que l'air.
Enoncer
la loi des gaz parfait en expliquant les termes et en précisant les
unités.
PV = nRT avec pression P en pascal, volume V en m3, n :
quantité de matière en mol ; T : température en kelvin et R = constante
= 8,32 J K-1 mol-1.
Etudions la réaction suivante dont l'équation est incomplète :
MnO4-aq + ... +H2C2O4aq
--> Mn2+aq +... +CO2aq.
Comment
se nomme ce type de réaction ? Oxydoréduction.
Sachant qu'elle se déroule en milieu acide, compléter l'équation
bilan.
Réduction de l'oxydant : 2 fois {MnO4-aq
+8H+aq + 5e- = Mn2+aq +4H2O
}.
Oxydation du réducteur : 5 fois {H2C2O4aq
= 2H+aq + 2e- +2CO2aq}.
Ajouter et simplifier : 2MnO4-aq
+16H+aq + 10e- +5H2C2O4aq
= 2Mn2+aq +8H2O+10H+aq + 10e-
+10 CO2aq.
2MnO4-aq +6H+aq +5H2C2O4aq
= 2Mn2+aq +8H2O +10 CO2aq.
le dégagement gazeux trouble l'eau de chaux. Ecrire l'équation de
la réaction correspondante.
Ca2+aq +2HO-aq + CO2aq = CaCO3(s)
+ H2O(l).
|
|
Etudions
la réaction suivante :
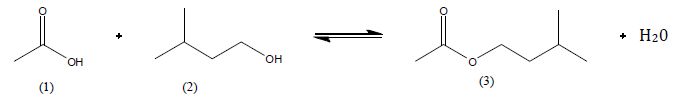
Comment
se nomme ce type de réaction ?
Estérification limitée par l'hydrolyse de l'ester.
Nommer les réactifs
et les produits.
(1) acide éthanoïque ( ou acétique ) ; (2)
3-méthylbutan-1-ol ; (3) ; éthanoate de 3-méthylbutyle.
On ajoute quelques gouttes d'acide sulfrique
comme catalyseur.
Donner
la définition d'un catalyseur.
Un
catalyseur augmente la vitesse d'une réaction sans intervenir dans le
bilan global.
Etudions la réaction suivante : ZnCl2aq + 2NaOHaq-->
Zn(OH)2 (s) + 2NaCl aq.
Comment se nomme ce
type de réaction ? Précipitation.
Exprimer la vitesse
v de la réaction en fonction de la variation de la concentration des
espèces. Préciser les unités de v.
v = 1/V dx/dt avec V : volume (L) de la solution, x avancement (mol); v
= vitesse en mol L-1 s-1.
[NaCl
aq]
=2x / V ; v = ½d [NaCl
aq]/dt.
[ZnCl2aq] =c0-x ; v = -d[ZnCl2aq]/dt.
[NaOH] =c'0-2x ; v = -½d[NaOH]/dt.
Intervalle de confiance [0,512 ; 0,559]
Quelle est la valeur
de cette vitesse à l'équilibre ?
La composition du mélange à l'équilibre est
constante. la vitesse de la réaction est nulle.
|
|
|