Corrosion
en milieu marin,
concours général 2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Les
bouteilles de plongée sont fabriquées majoritairement en acier
(alliage fer-carbone) ou en aluminium (plus léger que l’acier). En
milieu marin, elles sont soumises à un environnement difficile et
peuvent souffrir de corrosion due à la
présence de dioxygène dissous. La corrosion correspond à l’oxydation
d’un métal par le dioxygène dissous.
Il peut donc y avoir formation d’oxydes de fer (rouille) ou encore de
cations Fer II ou Fer III.
Le diagramme potentiel-pH (E/pH) d’une espèce indique les domaines de
prédominance des phases condensées,
et des espèces dissoutes pour les différents états d’oxydation de
l’espèce considérée en fonction du pH. Ce
diagramme nous donne donc des informations sur les espèces
thermodynamiquement stables à pH donné.
Le diagramme potentiel-pH suivant représente le diagramme du
fer superposé à celui de l’eau.
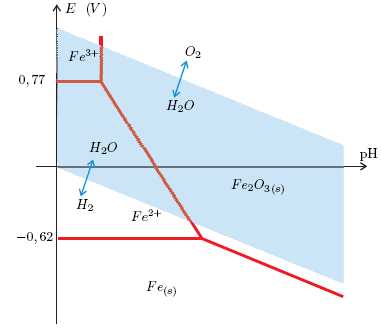
Nommer les couples relatifs à l’eau mis en jeu dans ce diagramme.
Repérer, dans chacun de ces couples, l’oxydant et le réducteur.
L'oxydant est écrit en premier, le réducteur en second : oxydant / réducteur.
O2 /H2O et H2O / H2.
Relever les couples relatifs au fer en indiquant de la même
manière pour chaque couple l’oxydant et le réducteur.
Fe2+/Fe(s) ; Fe3+/Fe2+ ; Fe2O3(s) /Fe(s) ; Fe2O3(s) /Fe2+.La superposition de ces deux diagrammes permet de repérer quels
sont les dérivés du fer susceptibles de coexister en phase aqueuse. Existe-t-il un domaine où le fer solide
(Fe(s)) est thermodynamiquement stable en présence d’eau ?
Non, le fer et l'eau appartiennent à des domaines distincts.
Ecrire la réaction pouvant avoir lieu entre le fer et l’eau en
milieu acide. Cette réaction peut-elle être qualifiée de lente ou rapide ? Quels sont les produits formés
et que devrait-on observer lors de cette réaction ?
Fe(s) + 2H3O+aq --> Fe2+aq +H2(g) + 2H2O(l). Cette réaction est assez lente.
Ecrire la réaction entre le fer et le dioxygène dissous dans
l’eau. Cette réaction risque-t-elle d’être plus rapide ou moins rapide que celle du fer avec l’eau ? Justifier.
2Fe(s) +O2aq +2H2O(l)--> 2Fe2+aq +4HO-aq.
Le dioxygène est un oxydant plus puissant que l'eau : cette réaction sera plus rapide que l'oxydation du fer par l'eau.
Ce
type de diagramme permet d’obtenir des informations thermodynamiques
sur des réactions d’oxydo-réduction, mais il ne permet pas d’étudier la
cinétique, c’est à dire la vitesse de ces réactions. Le phénomène qui
vient d’être mis en évidence correspond à la corrosion du fer.
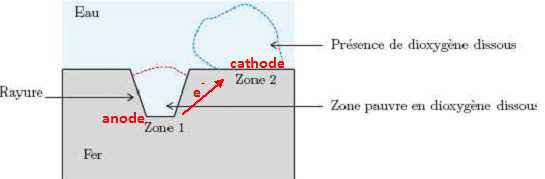
La corrosion est particulièrement présente dans les zones qui présentent une hétérogéenéeité de surface
(rayure,
contrainte, d´efaut), une hétérogénéité de composition (alliages,
impuretés, soudures), ou encore une hétérogénéité de la concentration
du milieu. Une quelconque de ces hétérogénéités provoque ce qu’on
appelle une corrosion différentielle : l’oxydation et la réduction se
produisent en deux zones différentes du métal immergé, le métal
assurant la circulation des électrons. Les couples mis en jeu dans la
corrosion du fer sont : Fe2+/Fe et O2/OH−.
Ecrire
les demi-équations électroniques correspondant à ces deux couples en
considérant l’oxygène dissous en milieu aqueux. En déduire l’équation
bilan liée au phénomène de corrosion du fer.
Oxydation à l'anode négative : 2 Fe(s) = 2Fe2+aq +4e- ;
réduction à la cathode positive : O2aq +2H2O +4e-=4HO-aq.
2 Fe(s) +O2aq +2H2O = 2Fe2+aq +4HO-aq. Repérer
la zone correspondant à la réduction et celle correspondant à
l’oxydation. Identifier alors l’anode et la cathode et indiquer sur un
schéma le déplacement des électrons dans le métal.
|
| ..
.. |
|
|
L’association de l’anode et de la cathode constitue une micropile en court-circuit. Le déplacement des ions dans l’eau vient fermer le circuit électrique. La pièce métallique étant plongée dans l’eau salée, le déplacement des ions est facilité par la présence des ions Na+ et Cl−.
La vitesse de cette réaction est liée au nombre d’électrons échangés entre les électrodes. Nous allons établir le lien entre la vitesse de la réaction et l’intensité du courant électrique de cette micropile. On note les potentiels d’électrode à l’anode et à la cathode Va et Vc. Dessiner le schéma équivalent de cette micropile en court-circuit.
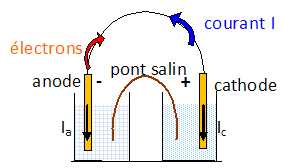
Par convention, le courant est orienté dans le sens électrode-solution. On note Ia et Ic l’intensité du courant respectivement à l’anode et à la cathode.
Etablir la relation entre les potentiels d’électrode Va et Vc ainsi que la relation entre les courants Ia et Ic.
La pile étant en court-circuit les potentiels des deux électrodes sont identiques. Les courants Ia et Ic ont même valeur mais sont de sens contraire.
On note n1 la quantité initiale de fer, n2 la quantité initiale de dioxygène et x l’avancement de la réaction (en mole), c’est-à-dire la quantité de dioxygène consommé. Etablir le lien entre l’avancement x de la réaction de corrosion et le nombre de moles d’électrons échangés à l’anode ne.
| avancement (mol) | O2aq | +2H2O | +4e- | =4HO-aq. | | initial | 0 | n2 | solvant | 0 | 0 | | en cours | x | n2-x | ne=4x | 4x |
La vitesse de réaction est définie grâce à l’avancement de la réaction par v = dx /dt et l’intensité du courant électrique à l’anode par ia = dq / dt où q représente la charge échangée à l’anode. On note e = 1, 60.10−19 C la charge élémentaire et on introduit la constante de Faraday F. Cette constante représente la charge d’une mole de charges élémentaires. Exprimer la constante F et la calculer en précisant l’unité.
F = NA e =6,02 1023*1,6 10-19 =9,632 104 ~9,6 104 C mol-1.
Etablir la relation entre l’intensité du courant, la vitesse de réaction, et la constante de Faraday F. Comment évaluer la vitesse du phénomène de corrosion ?
v = dx/dt = 0,25 dne/dt ; ia = dq / dt =F dne/dt ; v = 0,25 ia / F.
Evaluer l'intensité du courant, cest évaluer la vitesse de la réaction. Plus ia est grand, plus la réaction est rapide.
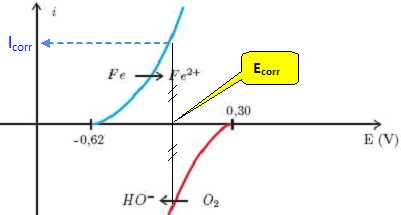
Indiquer graphiquement le point de fonctionnement de cette micropile. On notera icor le courant de court-circuit correspondant au courant de corrosion, et Ecor le potentiel de corrosion. Evaluer le potentiel de corrosion Ecor.
|
.
|
|
Des mesures électrochimiques ont permis de mesurer l’ordre de grandeur du courant surfacique de corrosion jcor = 30 μA/cm2. Evaluer l’épaisseur du métal consommé lors d’une plongée d’une durée de 2 h pour une rayure de profondeur p = 1 mm de surface Sr = 0, 5 cm2 sur une bouteille de plongée en acier.
Icorr =jcorr Sr =30*0,5 =15 µA =1,5 10-5 A. Q = Icorr t = 1,5 10-5 *2*3600 =0,108 C ; ne = 0,108 / (9,6 104)=1,13 10-6 mol.
Fe(s) = Fe2+aq +2e- ; n(Fe) =½ ne =0,5*1,13 10-6 =5,63 10-76 mol.
m(Fe) = n(Fe) M(Fe) =5,63 10-7 *56 =3,15 10-5 g.
Volume de fer = V =m(Fe) / rfer =3,15 10-5 / 7,8 ~4,0 10-6 cm3.
Epaisseur : V/Sr =4,0 10-65 /0,5 ~8,0 10-6 m.
Les
bouteilles de plongée doivent présenter une bonne tenue en pression et
sont donc fabriquées à partir de plaques d’acier d’épaisseur 8 mm.
Cette épaisseur ne doit pas être inférieure à 6 mm. Sachant que les
plongeurs utilisent leurs bouteilles durant plusieurs années, conclure quant au danger de la corrosion.
8-6 = 2 mm = 2 10-3 m ; nombre de plongées possibles : 2 10-3 /(8,0 10-6)=250 plongées. de 2 h. La corrosion ne présente pas de danger.
Il
existe différents types de protection pour éviter la corrosion.
L’oxydation de certains métaux comme le zinc ou l’aluminum forme une
couche superficielle et imperméable d’oxyde. Ainsi le métal se
retrouve isolé de l’eau et du dioxygène dissous. La corrosion est
stoppée. Il s’agit d’une protection par passivation. Dans le cas du
fer, la couche d’oxyde qui se forme n’est pas assez imperméable et ne
protége pas efficacement le métal. La corrosion se poursuit.
Le
métal peut aussi être protégé par une couche physique (peinture, film
plastique, émail...) interdisant ainsi le contact m´etal/eau. Cette
protection est efficace tant que la couche protectrice n’est pas
altérée.
Cette protection ne résiste pas toujours aux rayures ou aux
chocs. Le dépôt d’une couche d’un autre méetal résiste mieux à la
corrosion. Ce dépôt est réalisé soit par électrolyse, soit par
galvanisation (immersion dans un bain de métal fondu). Lorsqu’il se
produit une rayure, une micropile se forme.
En
analysant les figures suivantes, expliquer ce qu’il se passe en
présence d’une rayure sur une bouteille de plongée recouverte de nickel
ou de zinc. Choisir le métal permettant d’assurer la protection de la
bouteille de plongée.
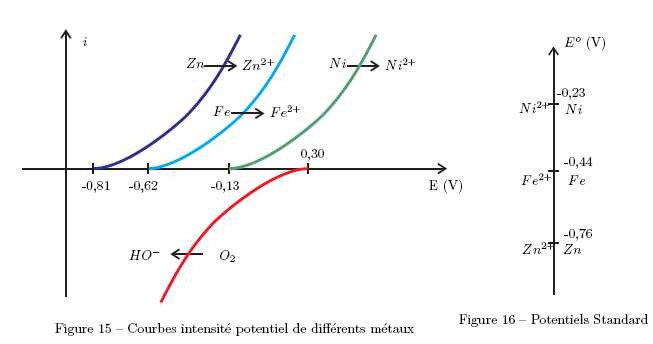
Le
zinc est plus réducteur que le fer. Il va s'oxyder ( anode
sacrificielle) à la place du fer et le fer sera protégé tant qu'il y
aura du zinc sur la bouteille.
Par contre le nickel moins réducteur que le fer, ne convient pas.
|
|