Stéréoisomérie
optique.
Concours général 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
On
parle de stéréoisomèrie optique dans le cas par exemple de molécules
possédant un ou plusieurs atomes de carbone asymétriques. Ces molécules
sont dites chirales ; un objet chirale est un objet non superposable
à son image dans un miroir plan. La chiralité se manifeste par
une propriété physique : l'activité optique. Quand une lumière
polarisée rectilignement traverse une substance chirale, la direction
du plan de polarisation est déviée. L'appareil utilisé pour mesurer
cette déviation est appelé polarimètre.
Pour illustrer ces propriétés on s'intéresse ici à différents sucres.
Dénombrement et représentation des stéréoisomères de configuration.
Représenter
en formule semi-développée ou topologique le 2,3,4trihydroxybutanal.
Indiquer les différents atomes de carbone asymétriques. Quel est le
nombre de stéréoisomères de configuration de ce sucre ?
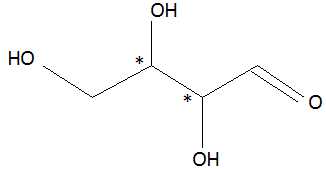
A partir de 2 atomes de carbone asymétriques on peut prévoir au plus 22=4 stéréoisomères de configuration.
Représenter ces différents stéréoisomères et donner la relation qui les lie.
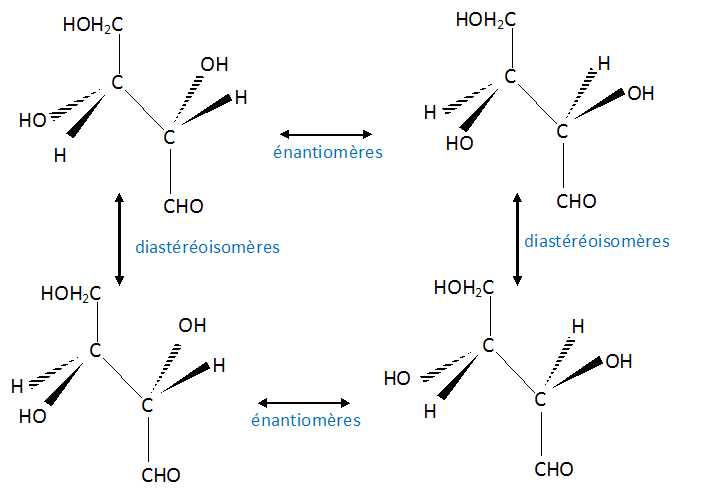
|
| ..
. |
|
|
Dosage polarimétrique d'une solution de glucose.
Le glucose est un sucre de formule C6H12O6 aussi appelé 2, 3, 4, 5, 6-pentahydroxyhexanal.
Donner une représentation semi-développée ou topologique de la molécule de glucose et faire apparaître les carbones asymétriques. 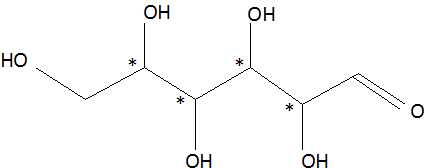
Le
glucose, composé chiral, possède une activité optique caractérisée par
un pouvoir rotatoire que l'on cherche à déterminer. Ce pouvoir
rotatoire correspond à l'angle a dont est dévié le plan de polarisation de la lumière incidente. 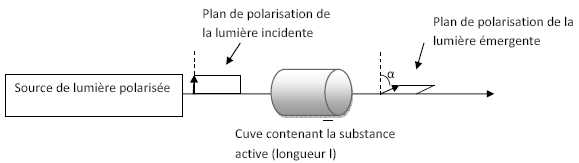
Le pouvoir rotatoire a
dépend des conditions expérimentales : concentration, longueur de la
cuve, longueur d'onde de la lumière utilisée et température. Mais, de
nombreuses substances suivent la loi de Biot.
a =[a]Tl l c.
a : pouvoir rotatoire en degrés ; l : longueur de la cuve en dm ; c : concentration de la substance en g/mL ;
[a]Tl
: pouvoir rotatoire spécifique de la substance active à la température
T et pour un rayonnement électromagnétique de longueur d'onde l exprimé en ° g-1 mL dm-1.
Pour
vérifier cette loi de Biot, on dispose d'une solution de sérum glucosé
à 10 % dans le traitement de l'hypoglycémie ou en tant que
véhicule pour apport thérapeutique en période opératoire. ( Le
pourcentage indiqué est un pourcentage massique ).
Connaissant la densité de cette solution, d = 1,03, déterminer la concentration massique en gL-1 en glucose de ce sérum.
Masse de 1 L de solution 1,03 kg ou 1,03 103 g. Masse de glucose dans 1 L de solution : 1,03 102 g L-1.
|
.
|
|
A
partir du sérum appelé solution mère, on réalise des solutions diluées
pour lesquelles on mesure avec le polarimètre de Laurent le pouvoir
rotatoire. La cuve utilisée a une longueur l = 2,00 dm.
| Vm(mL) solution mère prélevé | 50,0 | 40,0 | 30,0 | 20,0 | 10,0 | | VH2O (mL) | 0 | 10,0 | 20,0 | 30,0 | 40,0 | | c(gL-1) | 1,03 102 | 40 /50*1,03 102=82,4 | 61,8 | 41,2 | 20,6 | | a° | 10,90 | 8,72 | 6,54 | 4,36 | 2,18 |
Compléter la troisième ligne du tableau.
A partir de ces
mesures, vérifier que la solution de glucose suit la loi de Biot et
déterminer son pouvoir rotatoire spécifique.
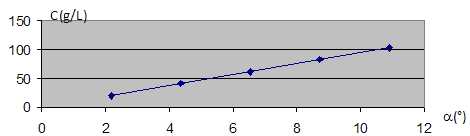
La courbe est une droite passant par l'origine : la loi de Biot est vérifiée.
c = 9,45 a ; a =0,106 c ; [a]Tl l =0,106 ; [a]Tl =0,106 / 2,00 =0,0529 ° g-1 L dm-1 =52,9 ° g-1 mL dm-1.
On
souhaite se servir des résultats précédents pour déterminer la
concentration et le pourcentage massique d'une solution de glucose dont
le flacon n'est pas étiqueté. On mesure alors avec le polarimètre
de Laurent le pouvoir rotatoire de cette solution en utilisant toujours
un tube de longueur 2,00 dm. On lit a = 5,40°.
En déduire la concentration massique en glucose de cette solution et son pourcentage massique.
c = 9,45 a = 9,45*5,40 = 51,03 ~51,0 g/L.
Si la densité de la solution est proche de 1, le pourcentage massique en glucose est : 5,10 %.
Cette
méthode de dosage du glucose n'est pas toujours valable. Elle ne
convient pas, par exemple dans le dosage du glucose d'un jus de fruit. Proposer une explication.
Le jus de fruit contient d'autres sucres, fructose, saccharose, molécules chirales.
|
|
|
Dosage du glucose dans un jus de fruit.
On réalise les manipulations suivantes :
-
Prélever à l'aide d'une pipette 10,0 mL de jus de fruit ; les verser
dans une fiole jaugée de 200,0 mL ; rincer la pipette et compléter
jusqu'au trait de jauge avec de l'eau distillée.
- Prélever à
la pipette 10,0 mL de la solution préparée à l'étape précédente ; les
introduire dans un becher de 100 mL ; y ajouter à la pipette 20,0 mL
d'une solution de diiode de concentration 0,030 mol/L, puis environ (
éprouvette graduée ) 10 mL de solution d'hydroxyde de sodium à 2 mol/L.
Agiter puis attendre 30 minutes.
- Ajouter ensuite 10 mL d'une
solution d'acide chlorhydrique à 2 mol/L. On observe l'apparition d'une
couleur brune caractéristique de la présence de diiode.
- Remplir
une burette de 25 mL avec une solution de thiosulfate de sodium à 0,100
mol/L. Effectuer le dosage jusqu'à disparition de la couleur brune ;
pour plus de précision, rajouter au cours du titrage quelques gouttes
d'empois d''amidon qui forme un complexe bleu avec le diiode ;
l'équivalence est détectée lorsque la solution devient incolore. On
note le volume équivalent Veq = 10,3 mL.
Ecrire les demi-équations électroniques relatives aux couples I2/I- et RCOO- / RCHO ; en déduire l'équation bilan de la réaction enntre le glucose et le diiode en milieu basique.
On admettra que le diiode est ici en excès.
I2 +2e- --> 2I- ; RCHO +3HO---> RCOO- +2H2O +2e-.
I2 + RCHO +3 HO- --> 2I- + RCOO- +2H2O.
Ecrire l'équation-bilan de la réaction de titrage enntre le diiode et le thiosulfate S2O32-.
I2 +2S2O32- ---> 2I- + S4O62-.
En
déduire la concentration du glucose dans la solution préparée à la
première étape, puis la concentration massique en glucose dans le jus
de fruit.
A l'équivalence n(I2)excès = ½n(S2O32-) =0,5*0,100*10,3 10-3 =5,15 10-4 mol.
n(I2)total =0,020 *0,030 = 6,0 10-4 mol.
n(I2)ayant réagi =(6-5,15) 10-4 =8,5 10-5 mol.
n(RCHO) =n(I2) =8,5 10-5 mol dans 10 mL de la solution préparée à la première étape.
8,5 10-5 /0,010 =8,5 10-3 mol/L.
Concentration du glucose dans le jus de fruit : 8,5 10-3 *20 =0,17 mol/L ou 0,17*180 = 30,6 g/L.
|
|
|




