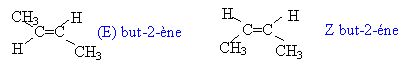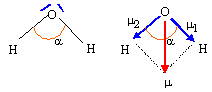Diastéréoisomérie
géométrique.
Concours général 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
On
parle de diastéréoisomérie géométrique ou stéréoisomérie Z / E
lorsqu'une molécule contient une liaison double C=C sur laquelle chaque
atome de carbone possède deux substituants différents. La présence de
la double liaison empêche la rotation de la liaison carbone-carbone, ce
qui conduit à une molécule plane possédanr deux configurations
possibles.
Donner un exemple simple de deux diastéréoisomères géométriques.
Propriétés physiques de l'acide maléique et de l'acide fumarique.
Ce sont deux acides carboxyliques éthyléniques diastéréoisomères l'un de l'autre.

L'acide
maléique obtenu par synthèse, est utilisé dans la formation de
polyesters et de copolymères acrylomaléiques intervenant dans certains
détergents. Son isomérisation en milieu acide conduit à l'acide
fumarique, produit présent dans les fruits et légumes. On donne les
températures de fusion et les solubilités dans l'eau à 25°C de ces deux
acides.
Acide maléique : Tf = 131°C ; solubilité : 780 g/L ; acide fumarique : Tf = 287 °C ; solubilité 6,30 g/L.
Représenter
les formules semi-développées des deux acides précédents en faisant
apparaître tous les doblets d'électrons, liants ou non-liants.
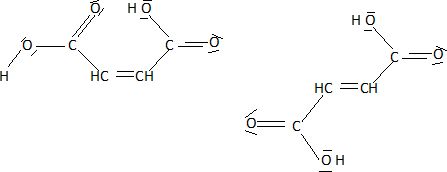
En déduire un interprétation de la différence des températures de fusion.
Les molécules d'acide fumarique sont associées par des liaisons
hydrogène intermoléculaires ; dans l'acide maléique, il y a de
nombreuses liaisons hydrogène intramoléculaires.
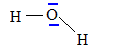
Donner le schéma de Lewis et la géométrie de la molécule d'eau. L'eau est-il un solvant polaire ou apolaire ? Justifier.
Schéma de Lewis de la molécule d'eau
: 
géométrie de la molécule
d'eau : modèle VSEPR
type AX2E2 : 2 paires liantes et
deux doublets non liants autour de l'oxygène, atome
central.
Ces 4 paires se disposent autour de l'atome central, de
telle manière que les répulsions soient
minimales.La molécule d'eau à la forme d'un V :
l'angle est inférieur à 109 ° 28 , la
répulsion entre les doublets non liants étant
plus importante que la répulsion entre les doublets
liants.
Le moment dipolaire de cette
molécule, noté PH2O vaut 1,85 D.
L'expérience suivante met en évidence ce
moment dipolaire :
Une règle en plexiglas est
électrisée par frottements ; on l'approche
d'un mince filet d'eau coulant du robinet : le filet d'eau
est dévié.
Pourcentage du caractère
ionique de la liaison OH : dO-H = 96
pm
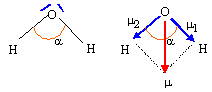
m1 =
m2 ; m = 2
m1 cos
(½a) ; m1
=m / ( 2cos (½a))
= 1,85 / (2*cos (104,5 / 2 )) = 1,52 D.
or 1 Debye = 1D = 3,33 10-30 C m d'où
m1 =1,52* 3,33
10-30 = 5,06 10-30 C m
Pourcentage de caractère ionique : m1
/( e dOH) = 5,06 10-30 / (1,6
10-19 * 96 10-12) = 0,329 (
33
%).
Interpréter la différence de solubilité des deux acides dans l'eau.
L'acide maléique est polaire ; l'acide fumarique est apolaire ( du fait de sa symétrie).
|
| ..
.. |
|
|
Propriétés acido-basiques de l'acide maléique et fumarique.Ces deux acides notés MalH2 et FumH2, sont des diacides dont les pKa sont donnés.
Acide maléique : pKa1 = 1,8 ; pKa2 =6,6 ; acide fumarique : pKa1 = 3,0 ; pKa2 = 4,5.
Que constate-t-on dans le cas de l'acide fumarique ?
Les deux pKa sont intermédiaires et voisins, du fait de l'absence de liaisons hydrogène intramoléculaires.
Par contre dans l'acide maléique, l'hydrogène lié à l'oxygène par
liaison hydrogène intramoléculaire est moins facile à libérer :
l'acidité diminue et le pKa croît. L'autre atome d'hydrogène est
déficitaire en électrons, donc plus facile à libérer ; l'acidité croît
et le pKa diminue.
Donner le diagramme de prédominance de l'acide maléique et de l'acide fumarique.
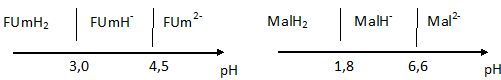
|
.
|
|
Pour comparer les propriétés acido-basiques de ces deux acides, on souhaite réaliser le dosage de V0 = 100 mL d'une solution d'acide maléique de concentration c0 = 1,00 10-2 mol/L et le dosage de V0 = 100 mL d'acide fumarique de même concentration c0. Pour cela, on dispose au laboratoire du matériel, des produits et des solutions suivantes :
Produits : acide maléique, acide fumarique, solutions d'hydroxyde de sodium à 1,00 10-2 mol/L et à 1,00 10-1 mol/L.
Matériel :
béchers 50 mL, 100 mL, 200 mL, 250 mL ; fioles jaugées 50 mL, 100 mL,
200 mL ; pipettes à deux traits 10 mL et 20 mL ; balance, spatule,
sabot de pesée, pH-mètre et électrodes, agitateur magnétique, est
distillée.
Etablir un protocole expérimental permettant de réaliser le dosage d'un des deux acides.
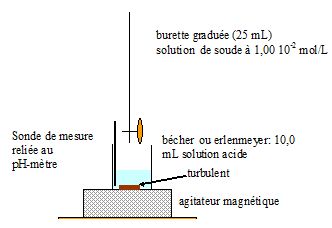
On donne ci-dessous les courbes simulées des titrages acido-basiques de
100 mL de solution d'acide maléique ( ou fumarique ) de concentration c0 par une solution d'hydroxyde de sodium de concentration c = 0,100 mol/L.
Etude de la courbe de titrage de l'acide maléique :
Déterminer
le pH aux deux équivalences ; en utilisant le diagramme de prédominance
établi précédemment, donner l'espèce prédominante. En déduire les
réactions de titrage ayant lieu sur chaque partie de la courbe.
Retrouver la valeur de la concentration de l'acide maléique.
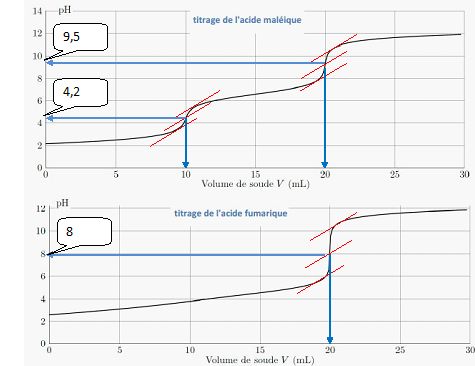
A la première équivalence ( pH ~4,2) MalH- prédomine : MalH2aq +HO-aq ---> MalH-aq + H2O.
A la seconde équivalence ( pH ~9,5) Mal2- prédomine : MalH-aq +HO-aq ---> Mal2-aq + H2O.
A la première équivalence : c0 V0= cB VE ; c0 = cB VE / V0= 0,100 *10 / 100 = 1,00 10-2 mol/L.
Etude de la courbe de titrage de l'acide fumarique.
A
partir de la valeur du pH à l'équivalence, donner la ou les réactions
ayant lieu au cours du titrage. Comment peut-on retrouver la valeur de
la concentration de l'acide fumarique ?
Donner un interprétation de la différence observée sur ces deux courbes.
Les deux pKa de l'acide maléique sont suffisamment diffrents pour observer les deux équivalences. Les deux pKa de l'acide fumarique sont proches. Les deux aciditées sont dosées simultanément et on observe qu'un seul saut de pH.
FumH2aq + 2HO-aq ---> Hum2-aq + 2H2O.
A l'équivalence : 2c0 V0= cB VE ; c0 = cB VE / (2V0)= 0,100 *20 / 200 = 1,00 10-2 mol/L.
|
|
|
Isomérisation de l'acide maléique en acide fumarique.
Dans certaines conditions, l'acide maléique s'isomérise en acide
fumarique. Pour essayer de comprendre ce phénomène, on réalise les
manipulations suivantes :
- Préparer 3 tubes à essaisA, B et C contenant chacun 2,5 g d'acide
maléique solide et 5 mL d'eau. Boucher les tubes à essais et agiter
jusqu'à dissolution complète de l'acide. Introduire dans les tubes A et
B 10 gouttes d'eau de brome. Boucher et agiter.
- Placer le tube A à l'obscurité et les tubes B et C sous une lampe UV pendant 20 minutes.
On observe la formation de cristaux blanc dans le tube B.
Proposer une méthode expérimentale permettant de récupérer et d'identifier les cristaux blancs.
Filtration, lavage à l'eau froide, séchage et mesure du point de fusion sur banc Kofler.
Cette identification permet de vérifier la formation d'acide fumarique.
Quels
sont les facteurs permettant l'isomérisation de l'acide maléique en
acide fumarique ? Pourquoi l'acide fumarique obtenu précipite-t-il ?
Isomérisation photochimique en présence d'un catalyseur, le dibrome.
L'acide fumarique est très peu soluble dans l'eau : il précipite.
|
|
|