Conductimétrie,
nitroaniline, jaune d'alizarine, carbonyle, catalyseur. Concours
Puissance 11 ( Fesic )
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Exercice
12.
Le synthol@, créé en 1925 par M. Roger, est une solution alcoolisée
utilisée en application locale pour calmer les douleurs,
décongestionner et désinfecter. On peut lire sur la notice (cadre
ci-dessous), la composition du médicament.
Pour 100 g de solution, la composition en substance active est :
Levomenthol : 0,2600 g ; Vératrole : 0,2600 g ; Résorcinol : 0,0210 g ;
Acide salicylique : 0,0105 g
Les autres composants sont l'huile essentielle de géranium, l'huile
essentielle de cédrat, le jaune de quinoléine (E104).
Toutes les espèces chimiques présentes dans le Synthol@ sont
solubilisées dans un solvant à base d'éthanol à 96% et d'eau purifiée
(titre alcoolique 34,5% en volume).
On souhaite vérifier la concentration molaire en acide salicylique (C7H6O3).
Pour cela, on effectue un titrage
conductimétrique. Le volume du Synthol@ dosé est Va
= 100,0 mL et la solution titrante est une solution de soude (Na+(aq)
+ HO-aq)).
L'équation associée à la réaction du titrage est :
C7H6O3 (aq)+HO-aq ---> C7H5O3 -(aq)+H2O.
La courbe de titrage
est représentée ci-dessous :
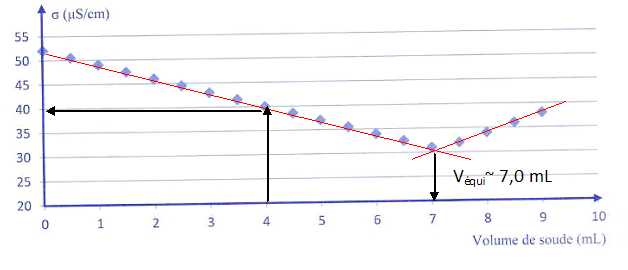
a) Pour trouver le
volume équivalent, on utilise la méthode des tangentes. Faux.
b)
A l'équivalence, la concentration molaire des ions sodium Na+aq
est égale à celle des ions hydroxyde HO-aq. Faux.
c)
Au-delà de 7,0 mL de soude ajoutée, il n'y a plus d'acide salicylique
dans la solution. Vrai.
d) A 4,0 mL de soude
ajoutée, la conductivité mesurée est égale à 4,0 mS.m-l. Vrai.
On lit : 40 µS cm-1 ; 1 µS = 10-3 mS ; 1 cm = 10-2 m ; 1 µS cm-1 = 10-3 *102 =0,1 mS m-1.
|
|
|
Exercice
13.
La 4-nitroaniline (4b) est utilisée
comme précurseur de la p-phényldiamine qui est utilisée comme colorant.
Les étapes d'une synthèse de la 4-nitroaniline (4b) à partir de
l'aniline sont indiquées ci-dessous. Après cette synthèse, la
séparation doit être réalisée afin d'isoler la 2-nitroaniline (4a), qui
est également formée en petite quantité au cours de cette synthèse.
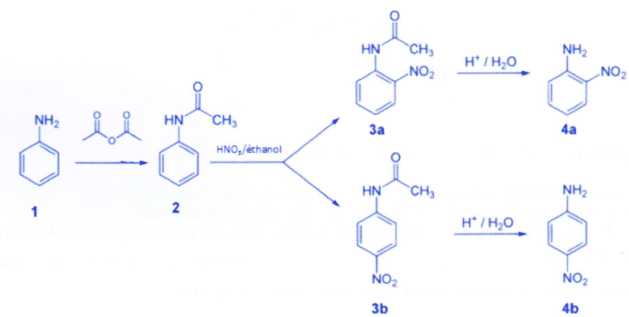
a) La première étape
permet de protéger la fonction amine. Vrai.
b)
La première étape conduit à la formation d'un ester. Faux.
La fonction
amine est protégée par la fonction amide.
c)
La deuxième étape, mettant en oeuvre l'acide nitrique (HNO3),
donne lieu à des réactions d'addition. Faux.
Substitution
électrophile sur le cycle benzénique.
d)
La synthèse conduit à la formation de deux stéréoisomères. Vrai.
|
.
|
|
Exercice
14.
Le jaune d'alizarine est un indicateur coloré. La forme acide a une
teinte jaune et la forme basique une teinte rouge.
La formule topologique de la forme prépondérante à pH =13 est
représentée ci-dessous :
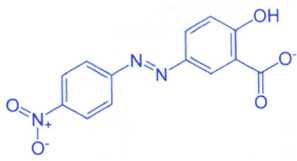
Donnée : pKa(forme acide du jaune
d'alizarine/forme basique) = 11.
a)
La molécule représentée ci-dessus correspond à la forme acide de
l'indicateur coloré. Faux.
La forme
acide possède un groupe carboxyle COOH et sa base
conjuguée le groupe carboxylate COO-.
b)
La molécule de jaune d'alizarine possède six atomes de carbone
asymétriques. Faux.
Tous les
atomes de carbone sont trigonaux.
c)
A pH =13, la concentration de la forme basique de l'indicateur coloré
est 100 fois supérieure à celle de la forme acide. Vrai.
pH = pKa +
log ( [base conjuguée ] / [acide]) ; log ( [base conjuguée
] / [acide]) = pH-pKa = 13-11 = 2 ; [base conjuguée ] / [acide] =100.
La
dernière étape de la synthèse du jaune d'alizarine est la réaction
suivante :

d)
Il s'agit d'une réaction de substitution. Vrai.
|
|
|
Exercice
15.
François Auguste Victor Grignard (6 mai 1871 à
Cherbourg, France - l3 décembre 1935 à Lyon, France), un chimiste
français, a reçu le prix Nobel de chimie en l9l2 pour ces travaux
sur les organomagnésiens. Un organomagnésien, également appelé réactif
de Grignard, se note R-MgBr. Le groupement R sera ici le
groupe vinyle H2C=CH-.
Un organomagnésien réagit avec un composé, contenant un groupe
carbonyle, en deux étapes.
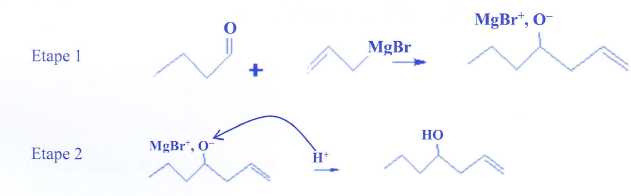
a) La première étape
est une réaction d'addition.
Vrai.
Une double
liaison C=O disparaît et deux liaisons simples sont créées.
b)
Une flèche courbe correspond au déplacement d'un doublet d'électrons. Vrai.
Sur le
schéma cette flèche n'est pas dans le bon sens.
c)
L'atome de carbone du groupe carbonyle porte une charge partielle d-.
Faux.
Cet atome de
carbone est déficitaire en électrons.
d)
Le sens de la flèche courbe, dans l'étape 2, est correct. Faux.
Exercice 16.
Pour étudier la sélectivité d'un catalyseur, on s'intéresse aux deux
réactions suivantes :
Le passage de vapeurs d'éthanol (C2H5OH)
sur du cuivre (Cu(s)) chauffé à 280°C, sous une pression de 1 bar,
conduit à la formation d'éthanal (CH3CHO) et de
dihydrogène (H2).
Le passage de vapeurs d'éthanol (C2H5OH)
sur de l'alumine (Al2O3(s))
chauffée à 400°C, sous une pression de 1 bar, conduit à la formation
d'éthylène (C2H4) et
d'eau (H2O).
Donnée : température d'ébullition de l'éthanol sous 1 bar
: 78°C.
a)
Dans les deux réactions, il s'agit de catalyse homogène. Faux.
Le
catalyseur est solide, l'éthanol est gazeux.
b)
Les deux catalyseurs sont sélectifs. Vrai.
c) L'éthanal est un
aldéhyde. Vrai.
d) La
déshydrogénation de 0,92 g d'éthanol en présence de cuivre conduit à la
formation de 20 mmol de gaz dihydrogène.
Vrai.
n(éthanol)
= 0,92 / m(éthanol) =0,92 / 46 = 0,020 mol = 20 mmol.
C2H5OH
--->CH3CHO +H2.
|
|
|