D'une odeur acre à
une odeur fruitée.
Bac S 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Il
est relativement aisé de passer d’un produit ayant une odeur âcre,
comme l’acide formique, à l’odeur fruitée d’un ester. C’est ce
qu’illustre le protocole décrit ci-après de la synthèse du méthanoate
de butyle à partir de l’acide formique.
Protocole.
Préparer un bain-marie à une température d’environ 50 °C. Sous la
hotte, verser dans un erlenmeyer 7,5 mL d’acide formique, puis 18,0 mL
de butan-1-ol, ajouter 3 gouttes d’acide sulfurique concentré.
Surmonter l’erlenmeyer contenant le mélange d’un réfrigérant à air, le
placer dans le bain-marie et assurer une agitation douce.
L’équation de la réaction de synthèse est :
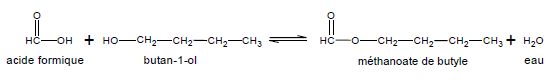
Réaction de synthèse du méthanoate de butyle et son mécanisme
Quel est le nom en nomenclature officielle de l’acide formique ?
Acide méthanoïque.
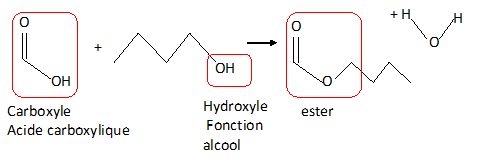
Recopier l’équation de la réaction de synthèse étudiée en utilisant une écriture topologique. Encadrer
les groupes caractéristiques et nommer les fonctions correspondantes.
Décrire la modélisation de l’étape (a) du mécanisme réactionnel.
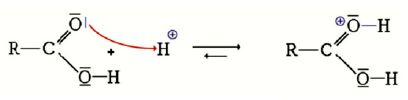
Attaque du doublet de l'atome d'oxygène (nucléophile) sur le site électrophile du proton H+ avec formation d'une liaison chimique.
Compléter
les étapes (c) et (e) à l’aide des flèches courbes nécessaires. Pour
chacun des cas, indiquer s’il s’agit d’une formation ou d’une rupture
d’une liaison.
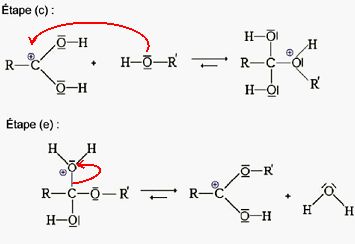
Etape (c) : formation d'une liaison ; étape (e) : rupture d'une liaison.
Comment peut-on expliquer l’existence des charges positives portées par les atomes d’oxygène et de carbone dans l’étape (e) ?
L'atome de carbone compte 4 électrons externes. Dans le produit de
l'étape (e) , ce carbone ne met en oeuvre que trois liaisons simples (
3 électrons) ; il a pardu un électron d'où la charge positive qu'il
porte.
L'atome d'oxygène compte six électrons externes ( 2 doulets et deux électrons célibataires).
Dans l'étape (e) cet atome porte un doublet non liant et met en oeuvre
3 liaisons ( 3 électrons) ; soit un total de 5 électrons externes : il
en a perdu un, d'où la charge positive qu'il porte.
|
| .
. |
|
|
Optimisation du protocole de synthèse.
Le mélange de réactifs dans le protocole décrit est-il stoechiométrique ? Justifier.
Masse d'acide formique : m = volume ( mL) * densité = 7,5 *1,22 =9,15 g.
M(HCOOH) = 46,0 g/mol ; quantité de matière d'acide formique : n = 9,15 / 46,0 =0,199 ~0,20 mol.
Masse d'alcool : m = volume ( mL) * densité = 18 *0,81 =14,6 g.
M(alcool) = 74,0 g/mol ; quantité de matière d'alcool : n = 14,6 / 74,0 =0,197 ~0,20 mol.
Le mélange initial est en proportions stoechiométriques.
Identifier la courbe correspondant au protocole décrit. Justifier.
Le protocole indique une température de 50°C et la présence d'acide
sulfurique ainsi qu'un mélange stoechiométrique : donc courbe c.
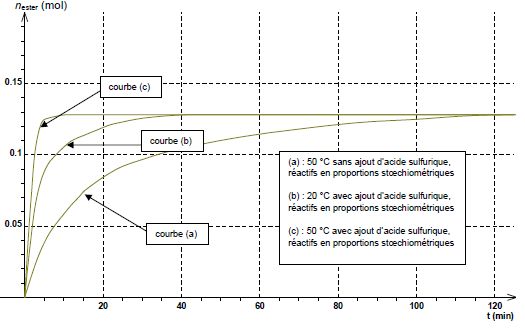
Déterminer le rendement de la synthèse dans le cas de ce protocole.
On peut espérer au mieux 0,20 mol d'ester dans l'hypothèse d'une réaction totale.
La courbe (c) indique la formation d'environ 0,13 mol d'ester.
Rendement : 0,13 / 0,20 = 0,65.
Effectuer une analyse détaillée de l’influence des conditions expérimentales sur la synthèse du méthanoate de butyle.
Température et catalyseur sont des facteurs cinétiques.
L'excès de l'un des réactifs déplace l'équilibre dans le sens direct,
formation de l'ester et en conséquence augmente le rendement.
|
.
|