Etude de l'acide
ascorbique. Bac S Antilles 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
Reproduire la molécule d'acide ascorbique et marquer d'un astérisque le ( ou les ) carbone(s) asymétrique(s).
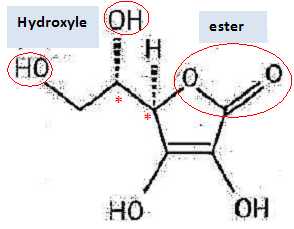 La molécule est-elle chirale ? Justifier.
La molécule est-elle chirale ? Justifier.
La molécule est chirale : présence de deux atomes de carbone asymétriques et absence d'élément de symétrie.
Quelle est la relation entre A et B. Préciser une éventuelle relation d'isomérie.
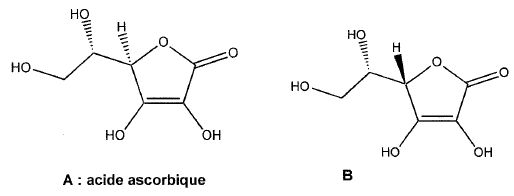
Un seul des atomes de carbone asymétriques a changé de configuration : A et B sont diastéréoisomères.
Comparer A aux espèces C, D et E. Justifier.
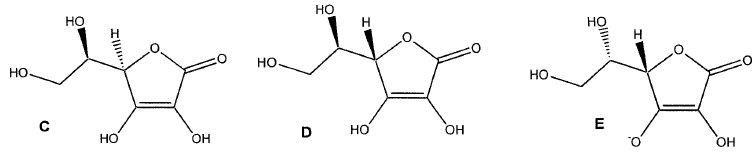
Un seul des atomes de carbone asymétriques a changé de configuration : A et C sont diastéréoisomères.
Les deux atomes de carbone asymétriques ont changé de configurations : A et D sont énantiomères.
Un seul des atomes de carbone asymétriques a changé de configuration : A et E sont diastéréoisomères.
De plus l'un des groupe hydroxyle a perdu un proton : A et E constituent un couple acide /base, l'acide étant A.
|
| .
. |
|
|
Déterminer la formule brute de l'acide ascorbique.
C6H8O6
Sur une boîte de comprimé d'acide ascorbique on lit : "500 mg par
comprimé". Un comprimé est écrasé dans un mortier. La poudre est
dissoute dans une fiole jaugée de 200 mL que l'on complète avec de
l'eau distillée jusqu'au trait de jauge. On obtient la solution S après
homogénéisation.On prélève V = 10,0 mL de cette solution que l'on titre
avec une solution d'hydroxyde de sodium de concentration cB =1,00 10-2 mol/L. On suit le titrage par pHmétrie. L'acide ascorbique sera noté AH dans la suite.
L'ion hydroxyde est une base forte en solution aqueuse.
Déterminer le pH de la solution ; en déduire les précautions qu'il convient d'adopter pour utiliser la solution.
pH = 14 + log cB = 14 + log 0,0100 = 14-2 = 12.
Port de blouse, de gants et de lunettes de protection.
|
.
|
|
Réaliser un schéma annoté du montage expérimental nécessaire à la mise en oeuvre d'un titrage.
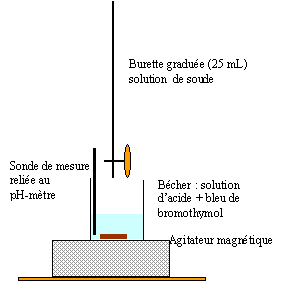
Ecrire l'équation de la réaction support du titrage.
AH aq + HO-aq ---> A-aq + H2O.
Déterminer la masse d'acide ascorbique contenue dans le comprimé.
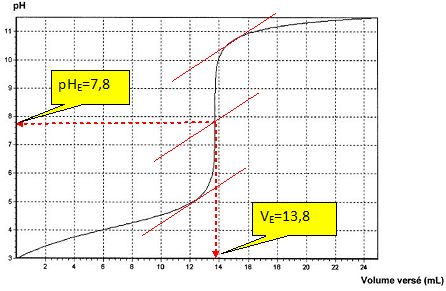
A
l'équivalence les quantités de matière des réactifs sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès,
après l'équivalence, l'autre réactif est en excès.
Quantité de matière d'ion hydroxyde : cB VE.
Quantité de matière d'acide ascorbique : [C6H8O6] V.
cBVE=[C6H8O6] V = 1,00 10-2 *0,0138 =1,38 10-4 mol dans 10 mL ou 2,76 10-3 mol d'acide ascorbique dans 200 mL.
M(C6H8O6) = 176 g/mol.
Masse d'acide ascorbique dans un comprimé : 2,76 10-3 *176 = 0,486 g ou 486 mg.
Ecart relatif : (500-486) / 500 = 2,8 10-2
ou 2,8 %. Sources d'erreurs possibles : précision de la verrerie,
prélevement imprécis du volume V, titre la soude carbonatée ou
non ).
Le résultat du dosage confirme l'indication "C500".
Peut-on savoir si l'acide ascorbique est fort ou faible ? Justifier.
La soude est une base forte ; l'acide ascorbique est un acide faible : le pH à l'équivalence est supérieur à 7.
|
|
|
Le titrage de l'acide ascorbique peut être réalisé en utilisant un indicateur coloré. Lequel ? Justifier.
Le pH du point équivalent doit appartenir à la zone de virage de l'indicateur coloré. Le rouge de crésol convient [ 7,2 ; 8,8 ].
A l'équivalence la couleur passe de la teinte acide ( jaune), AH en
excès avant l'équivalence, à la couleur de la teinte basique ( rouge),
HO- étant en excès après l'équivalence.
On envisage de réaliser un titrage conductimétrique d'une solution S'
d'acide ascorbique de concentration molaire voisine de 6 10-3 mol/L par une solution d'hydroxyde de sodium de concentration molaire c'b = 0,100 mol/L.
Expliquer
pourquoi il n'est pas pertinent de titrer la solution d'acide
ascorbique S' par une solution d'hydroxyde de sodium de concentration c'b.
Le volume de solution de soude versé à l'équivalence est voisin de 6 10-3 *10 / 0,1 ~0,6 mL pour une prise de 10 mL de solution S'. L'imprécision sur ce volume de soude est très grande.
Proposer un protocole expérimental permettant d'effectuer le titrage conductimétrique.
Verser dans un erlenmeyer de 500 mL, 200 mL de solution d'acide
ascorbique. Ainsi le volume de la solution dans l'erlenmyer varie peu
lors du titrage.
Ajouter mL par mL la solution titrante de soude à 0,100 mol/L et mesurer après chaque ajout la conductivité de la solution.
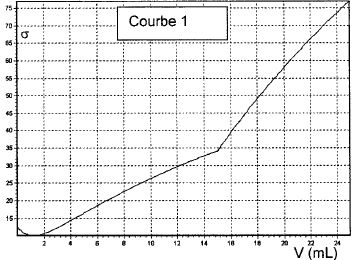
Tracer la courbe conductivité = f ( volume de soude ajouté ).
Identifier la courbe correspondant à ce titrage.
Du point de vue de la conductimétrie :
Avant l'équivalence la soude est en défaut, on ajoute des ions
sodium et il se forme des ions ascorbate : la conductivité croît
linéairement.
Après l'équivalence, la soude est en excès, on ajoute des ions sodium
et des ions hydroxyde ( la conductivité molaire ionique de ces derniers
est bien supérieure à celle des autres ions présents ) : la
conductivité de la solution augmente fortement et linéairement.
L'abscisse de la rupture de pente permet de déterminer le volume
équivalent.
|
|
|